Mag-Fura-2四钾盐*细胞不渗透*
AAT代理,Mag-Fura-2四钾盐*细胞不渗透*,微信同号 18301939375,部分现货,欢迎来电咨询
上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
C29H22K5N3O14
831.99
C44H47N3O24
1001.85
特点:
● 双波长激发检测钙离子
● 激光共聚焦,流式细胞仪均可检测
● 荧光强度高

产品性状
规格
性状 : 本产品为黄色或橙黄色粉末,使用时将固体溶解于无水DMSO中
纯度(HPLC): 98%以上
荧光光谱图: 符合实验要求
NMR光谱图: 符合实验要求
处理条件
保存方法 : 避光冷冻
产品概述
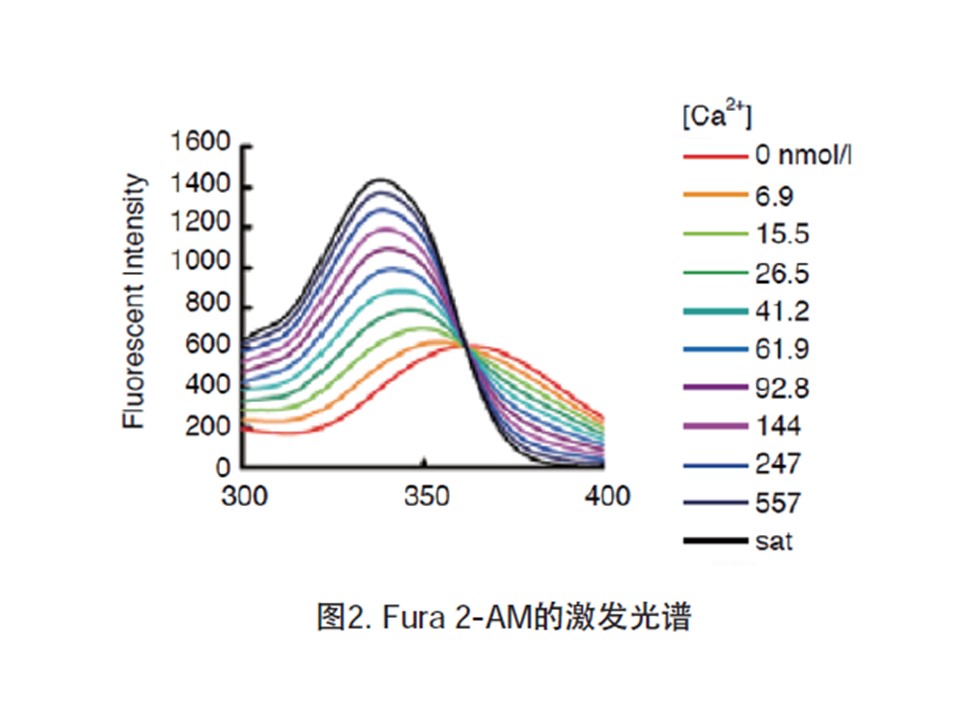
Fura 2-AM是一种可以穿透细胞膜的荧光染料。Fura 2-AM的荧光比较弱,最大激发波长为369 nm,最大发射波长为478 nm,并且其荧光不会随钙离子浓度改变而改变。Fura 2-AM进入细胞后可以被细胞内的酯酶剪切形成Fura 2,从而被滞留在细胞内。Fura 2和钙离子结合后,最大激发波长为335 nm(最大激发波长随离子浓度的的不同而有所不同),最大发射波长为505nm。实际检测时推荐使用的激发波长为340nm,发射波长为510 nm。如果做双波长检测,则推荐使用的激发波长为340 nm和380 nm。
原理
Fura 2可以和钙离子(Ca2+)结合,结合钙离子后在330-350 nm激发光下可以产生较强的荧光,而在380 nm激发光下则会导致荧光减弱。这样就可以使用340 nm和380 nm这两个荧光的比值来检测细胞内的钙离子浓度,可以消除不同细胞样品间荧光探针装载效率的差异,荧光探针的渗漏,细胞厚度差异等一些误差因素。
激发发射波长
Ex :340~380 nm
Em :510 nm

操作步骤
1、用HBSS溶液稀释1-5 mmol/l的Fura 2-AM母液,配制成1-5 μmol/l的Fura 2-AM工作液。
(此浓度仅供参考,请根据具体实验要求自行调整)
例如:1 mmol/l母液配制1 ml浓度为5 μmol/l工作液的方法:用1 ml HBSS溶液稀释5μl母液即可。
如果Fura 2-AM进入细胞的效果不好,可使用Pluronic® F-127,后者可以防止Fura 2-AM在缓冲液里
聚合并能促进其进入细胞。
*Pluronic® F-127先用DMSO溶解至浓度为20%(W/V),然后根据实验需要直接加入Fura 2-AM工作液
中至终浓度为0.04-0.05%(此浓度仅供参考,请根据具体实验要求自行调整)。
2、取出预培养的细胞,除去培养基,使用HBSS溶液洗涤细胞3次。
如果使用含血清的培养基,血清中的酯酶会分解AM体,从而降低Fura 2-AM进入细胞的效果。
另外含有酚红的培养 基会使本底值略微偏高,所以加工作液之前需尽量去除培养基残留。
3、加入Fura 2-AM工作液,溶液量以覆盖细胞为准。
4、37℃细胞培养箱孵育10-60分钟,除去Fura 2-AM工作液。关于孵育的时间,如果首次做实验不能定
建议先孵育30分钟,看荧光效果:如果细胞死亡较多,缩短时间;荧光强度太弱,延长时间。
5、用HBSS溶液洗涤细胞3次,以充分去除残留的Fura 2-AM工作液。然后加入HBSS溶液覆盖细胞。
6、37℃培养箱孵育约20-30分钟,以确保AM体在细胞内的完全去酯化作用。如果细胞内酯酶活性较低,
建议严格按照此操作进行;酯酶活性高的细胞实验,可以忽略此步。
7、用流式细胞仪或其它设备检测细胞,激发波长380 nm(Fura 2)和340 nm(钙离子-Fura 2),
发射波长510 nm。
注意事项
1、试剂容易吸潮,从冰箱取出后,请确认在干燥的环境放至室温后再开封。由于试剂极其微量,
开封前,请轻弹管壁几次,以保证粉末落入管底。
2、第一次使用时, 建议母液即配即用。试剂溶解后尽可能在短时间内使用,以保证实验效果。
3、溶解液DMSO需要保证新鲜无水,否则将会导致AM体水解,使荧光染料无法进入细胞,影响实验效果。
4、母液遇水极易分解,如果不能一次用完,建议分装保存,例如分装成5 μl/管,用封口膜封口,并用铝箔纸包裹,
放在一个密闭性能好的塑料袋中,并放入一包干燥剂,在≤-20℃密封避光保存。
5、建议您在正式实验前先摸索一下细胞量、钙离子荧光探针的终浓度、培养时间等,找到最佳实验条件。
数据处理
Fλ1与Fλ2分别是λ1与λ2激发时的总荧光强度,Sf 1与Sf 2是两种紫外光激发时游离Fura-2 (未结合Ca2+)的荧光系数,
Cf是游离的Fura-2浓度,Sb1与Sb2是相应波长下结合Ca2+后Fura-2的荧光系数,Cb是结合Ca2+的Fura-2浓度
参考文献
1) G. Grynkiewicz, M. Poenie and R. Y. Tsien, “A New Generation of Ca2+ Indicators with Greatly Improved Fluorescence Properties”, J. Biol. Chem., 1985, 260, 3440.
2) D. A. Williams, K. E. Fogarty, R. Y. Tsien and F. S. Fay, “Calcium Gradients in Single Smooth Muscle Cells Revealed by the Digital Imaging Microscope Using Fura-2”, Nature, 1985, 318, 558.
3) R. Y. Tsien, T. J. Rink and M. Poenie, “Measurement of Cytosolic Free Ca2+ in Individual Small Cells Using Fluorescence Microscopy with Dual Excitation Wavelengths”, Cell Calcium, 1985, 6, 145.
4) D. A. Williams and F. S. Fay, “Intracellular Calibration of the Fluorescent Calcium Indicator Fura-2”, Cell Calcium, 1990, 11, 75.
5) W. Almers and E. Neher, “The Ca Signal from Fura-2 Loaded Mast Cells Depends Strongly on the Method of Dye-loading”, FEBS Lett., 1985, 192, 13.
6) G. H. R. Rao, J. D. Peller and J. G. White, “Measurement of Ionized Calcium in Blood Platelets with a New Generation Calcium Indicator”, Biochem. Biophys. Res. Commun., 1985, 132, 652.
7) H. Ozaki, K. Sato, T. Satoh and H. Karaki, “Simultaneous Recordings of Calcium Signals and Mechanical Activity Using Fluorescent Dye Fura 2 in Isolated Strips of Vascular Smooth Muscle”, Jpn. J. Pharmacol., 1987, 45, 429.
8) M. Mitsui, A. Abe, M. Tajimi and H. Karaki, “Leakage of the Fluorescent Ca2+ Indicator Fura-2 in Smooth Muscle”, Jpn. J. Pharmacol., 1993, 61, 165.
Q&A
| Q1: 细胞内检测钙离子的试剂种类都有什么,选择什么样的比较好呢? |
| A1: 根据检测仪器和检测波长有很多的选择,产品后面标有AM的试剂是可以通过细胞膜的
有很多种相似的试剂,其特点如下: 【Fura 2】 •双波长激发 激发(λex= Ca:340 nm, Ca free:380 nm)、发射:λem=500 nm •解离常数:224 nmol/L •因为是荧光强度的比值、可以有效的减小误差 =>細胞内Ca浓度计算。 •该试剂被使用的最多 •必须要更换过滤片、会耽误一些时间。 【Fluo 3】 •单波长激发 激发:λex=508 nm、发射:λem=527 nm •解离常数:400 nmol/L •因为激发光在长波段,所以对细胞的损伤比较小 (不会受到NADH、NADPH的影响) •可以使用Ar激光激发装置。 •不适合切片中钙离子的检测 •【Fluo 4】 •单波长激发 •激发:λex=495 nm、发射:λem=518 nm •解离常数:360 nmol/L •与Fluo3相比对荧光强度更高。 •因为激发光在长波段,所以对细胞的损伤比较小 •(不会受到NADH、NADPH的影响) •可以使用Ar激光激发装置。 •与Fluo3相比对細胞的毒性低 •【Indo 1】 •单波长激发 •激发:λex= 330 nm、发射(λem= Ca:410 nm, Ca free:485 nm) •解离常数:250 nmol/L •由于不需要更换滤光片,可以很快地检测细胞内钙离子浓度变化以及像心肌细胞运动中钙离子的变化 •(需要两台检测仪器) •【Rhod 2】 •单波长激发 •激发:λex=553 nm、发射:λem=576 nm •解离常数:1.0 μmol/L •因为激发光在长波段,所以对细胞的损伤比较小 •(不会受到NADH、NADPH的影响) •可以使用Ar激光激发装置。 •【Quin 2】 •单波长激发 •激发:λex=339 nm、发射:λem=492 nm •解离常数:110 nmol/L •最早开发的产品 |
C44H47N3O24
1001.85
特点:
● 双波长激发检测钙离子
● 激光共聚焦,流式细胞仪均可检测
● 荧光强度高

产品性状
| 规格
性状 : 本产品为黄色或橙黄色粉末,使用时将固体溶解于无水DMSO中 纯度(HPLC): 98%以上 荧光光谱图: 符合实验要求 NMR光谱图: 符合实验要求 处理条件 保存方法 : 避光冷冻 |
产品概述
Fura 2-AM是一种可以穿透细胞膜的荧光染料。Fura 2-AM的荧光比较弱,最大激发波长为369 nm,最大发射波长为478 nm,并且其荧光不会随钙离子浓度改变而改变。Fura 2-AM进入细胞后可以被细胞内的酯酶剪切形成Fura 2,从而被滞留在细胞内。Fura 2和钙离子结合后,最大激发波长为335 nm(最大激发波长随离子浓度的的不同而有所不同),最大发射波长为505nm。实际检测时推荐使用的激发波长为340nm,发射波长为510 nm。如果做双波长检测,则推荐使用的激发波长为340 nm和380 nm。
原理
Fura 2可以和钙离子(Ca2+)结合,结合钙离子后在330-350 nm激发光下可以产生较强的荧光,而在380 nm激发光下则会导致荧光减弱。这样就可以使用340 nm和380 nm这两个荧光的比值来检测细胞内的钙离子浓度,可以消除不同细胞样品间荧光探针装载效率的差异,荧光探针的渗漏,细胞厚度差异等一些误差因素。
激发发射波长
Ex :340~380 nm
Em :510 nm
操作步骤
1、用HBSS溶液稀释1-5 mmol/l的Fura 2-AM母液,配制成1-5 μmol/l的Fura 2-AM工作液。
(此浓度仅供参考,请根据具体实验要求自行调整)
例如:1 mmol/l母液配制1 ml浓度为5 μmol/l工作液的方法:用1 ml HBSS溶液稀释5 μl母液即可。
如果Fura 2-AM进入细胞效果不好,可使用Pluronic® F-127后者可以防止Fura 2-AM在缓冲液里聚合
并能促进其进入细胞。
*Pluronic® F-127先用DMSO溶解至浓度为20%(W/V),然后根据实验需要直接加入Fura 2-AM工作液中
至终浓度为0.04-0.05%(此浓度仅供参考,请根据具体实验要求自行调整)。
2、取出预培养的细胞,除去培养基,使用HBSS溶液洗涤细胞3次。
如果使用含血清的培养基,血清中的酯酶会分解AM体,从而降低Fura 2-AM进入细胞的效果。
另外含有酚红的培养 基会使本底值略微偏高,所以加工作液之前需尽量去除培养基残留。
3、加入Fura 2-AM工作液,溶液量以覆盖细胞为准。
4、37℃细胞培养箱孵育10-60分钟,除去Fura 2-AM工作液。关于孵育的时间,
如果首次做实验不能确定,建议先孵育30分钟,看荧光效果:如果细胞死亡较多,缩短时间;
荧光强度太弱,延长时间。
5、用HBSS溶液洗涤细胞3次,以充分去除残留的Fura 2-AM工作液。然后加入HBSS溶液覆盖细胞。
6、37℃培养箱孵育约20-30分钟,以确保AM体在细胞内的完全去酯化作用。如果细胞内酯酶活性较低,
建议严格按照此操作进行;酯酶活性高的细胞实验,可以忽略此步。
7、用流式细胞仪或其它设备检测细胞,激发波长380 nm(Fura 2)和340 nm(钙离子-Fura 2)
发射波长510 nm。
注意事项
1、试剂容易吸潮,从冰箱取出后,请确认在干燥的环境放至室温后再开封。由于试剂极其微量,
开封前,请轻弹管壁几次,以保证粉末落入管底。
2、第一次使用时, 建议母液即配即用。试剂溶解后尽可能在短时间内使用,以保证实验效果。
3、溶解液DMSO需要保证新鲜无水,否则将会导致AM体水解,使荧光染料无法进入细胞,影响实验效果。
4、母液遇水极易分解,如果不能一次用完,建议分装保存,例如分装成5 μl/管,用封口膜封口,
并用铝箔纸包裹,放在一个密闭性能好的塑料袋中,并放入一包干燥剂,在≤-20℃密封避光保存。
5、建议您在正式实验前先摸索一下细胞量、钙离子荧光探针的终浓度、培养时间等,找到最佳实验条件
数据处理
Fλ1与Fλ2分别是λ1与λ2激发时的总荧光强度,Sf 1与Sf 2是两种紫外光激发时游离Fura-2 (未结合Ca2+)的荧光系数,
Cf是游离的Fura-2浓度,Sb1与Sb2是相应波长下结合Ca2+后Fura-2的荧光系数,Cb是结合Ca2+的Fura-2浓度
参考文献
1) G. Grynkiewicz, M. Poenie and R. Y. Tsien, “A New Generation of Ca2+ Indicators with Greatly Improved Fluorescence Properties”, J. Biol. Chem., 1985, 260, 3440.
2) D. A. Williams, K. E. Fogarty, R. Y. Tsien and F. S. Fay, “Calcium Gradients in Single Smooth Muscle Cells Revealed by the Digital Imaging Microscope Using Fura-2”, Nature, 1985, 318, 558.
3) R. Y. Tsien, T. J. Rink and M. Poenie, “Measurement of Cytosolic Free Ca2+ in Individual Small Cells Using Fluorescence Microscopy with Dual Excitation Wavelengths”, Cell Calcium, 1985, 6, 145.
4) D. A. Williams and F. S. Fay, “Intracellular Calibration of the Fluorescent Calcium Indicator Fura-2”, Cell Calcium, 1990, 11, 75.
5) W. Almers and E. Neher, “The Ca Signal from Fura-2 Loaded Mast Cells Depends Strongly on the Method of Dye-loading”, FEBS Lett., 1985, 192, 13.
6) G. H. R. Rao, J. D. Peller and J. G. White, “Measurement of Ionized Calcium in Blood Platelets with a New Generation Calcium Indicator”, Biochem. Biophys. Res. Commun., 1985, 132, 652.
7) H. Ozaki, K. Sato, T. Satoh and H. Karaki, “Simultaneous Recordings of Calcium Signals and Mechanical Activity Using Fluorescent Dye Fura 2 in Isolated Strips of Vascular Smooth Muscle”, Jpn. J. Pharmacol., 1987, 45, 429.
8) M. Mitsui, A. Abe, M. Tajimi and H. Karaki, “Leakage of the Fluorescent Ca2+ Indicator Fura-2 in Smooth Muscle”, Jpn. J. Pharmacol., 1993, 61, 165.
Q&A
| Q1: 细胞内检测钙离子的试剂种类都有什么,选择什么样的比较好呢? |
| A1: 根据检测仪器和检测波长有很多的选择,产品后面标有AM的试剂是可以通过细胞膜的
有很多种相似的试剂,其特点如下: 【Fura 2】 •双波长激发 激发(λex= Ca:340 nm, Ca free:380 nm)、发射:λem=500 nm •解离常数:224 nmol/L •因为是荧光强度的比值、可以有效的减小误差 =>細胞内Ca浓度计算。 •该试剂被使用的最多 •必须要更换过滤片、会耽误一些时间。 【Fluo 3】 •单波长激发 激发:λex=508 nm、发射:λem=527 nm •解离常数:400 nmol/L •因为激发光在长波段,所以对细胞的损伤比较小 (不会受到NADH、NADPH的影响) •可以使用Ar激光激发装置。 •不适合切片中钙离子的检测 •【Fluo 4】 •单波长激发 •激发:λex=495 nm、发射:λem=518 nm •解离常数:360 nmol/L •与Fluo3相比对荧光强度更高。 •因为激发光在长波段,所以对细胞的损伤比较小 •(不会受到NADH、NADPH的影响) •可以使用Ar激光激发装置。 •与Fluo3相比对細胞的毒性低 •【Indo 1】 •单波长激发 •激发:λex= 330 nm、发射(λem= Ca:410 nm, Ca free:485 nm) •解离常数:250 nmol/L •由于不需要更换滤光片,可以很快地检测细胞内钙离子浓度变化以及像心肌细胞运动中钙离子的变化 •(需要两台检测仪器) •【Rhod 2】 •单波长激发 •激发:λex=553 nm、发射:λem=576 nm •解离常数:1.0 μmol/L •因为激发光在长波段,所以对细胞的损伤比较小 •(不会受到NADH、NADPH的影响) •可以使用Ar激光激发装置。 •【Quin 2】 •单波长激发 •激发:λex=339 nm、发射:λem=492 nm •解离常数:110 nmol/L •最早开发的产品 |