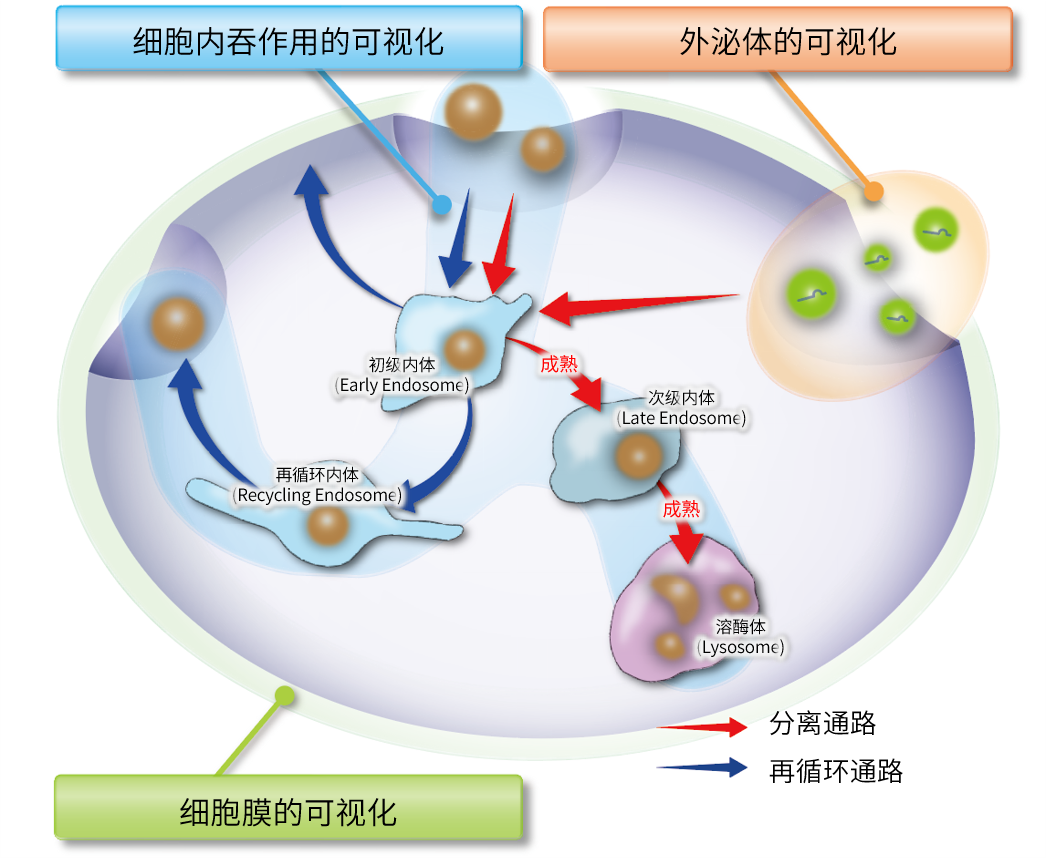
特点:
● 高特异性核仁定位
● 可通过共聚焦定量细胞成像仪进行定量分析
● 两种颜色可供选择

凑单关联产品TOP5
NO.1. Cell Counting Kit-8 细胞增殖毒性检测
NO.2. Cytotoxicity LDH Assay Kit-WST 乳酸脱氢酶(LDH)检测
NO.3. Fura2-AM 细胞内钙离子检测
NO.4. FerroOrange 细胞亚铁离子检测
NO.5. Lactate Assay Kit-WST 乳酸检测
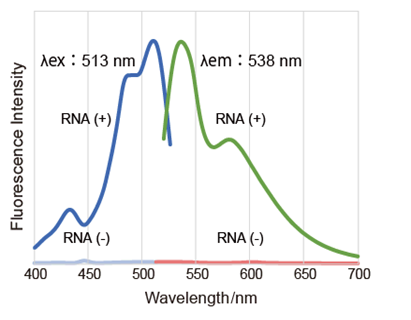
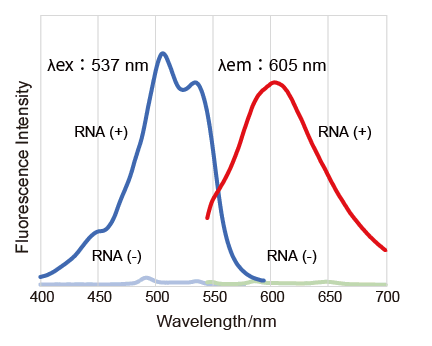
荧光特性
产品概述
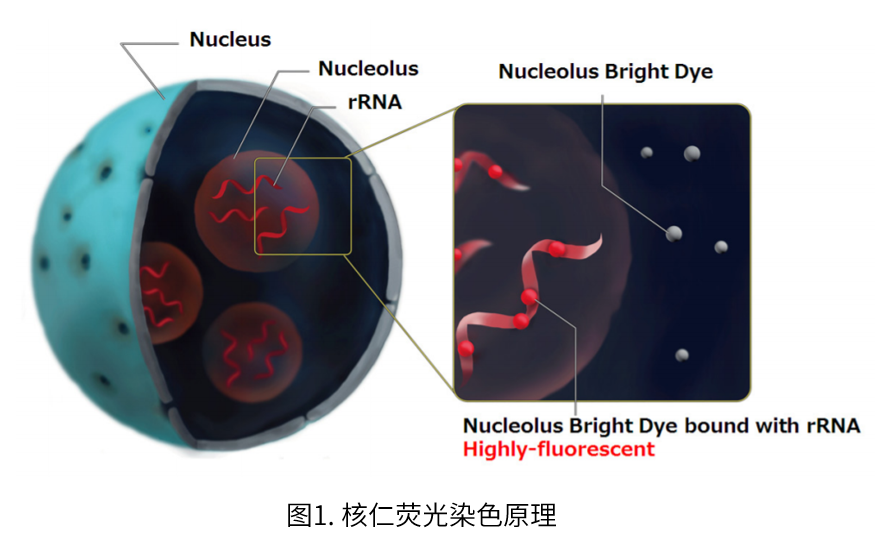
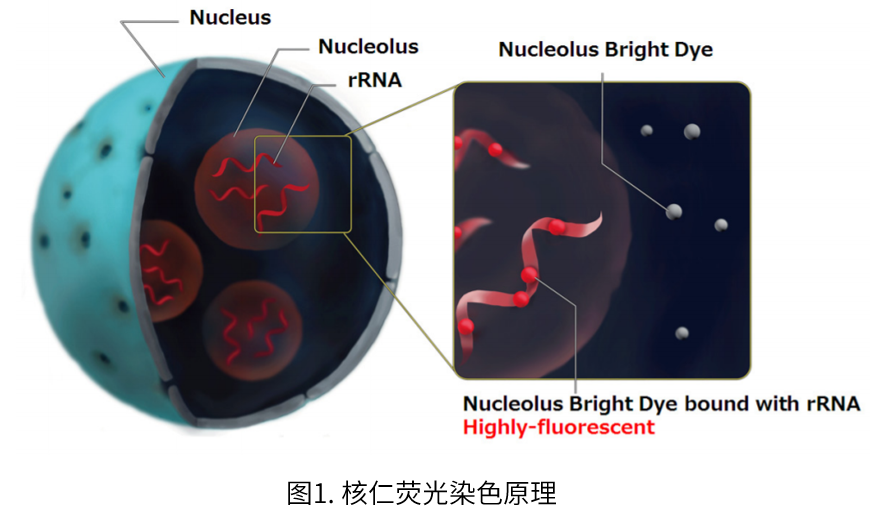
Nucleolus Bright是一种选择性与RNA结合并产生荧光的小分子荧光染料,只需在固定细胞中加入试剂即可成像。虽然Nucleolus Bright也会和在核仁以外存在的RNA反应,不过核仁作为细胞内RNA最多存在rRNA的产生场所,荧光尤为强烈。
成像时,通过与核染色试剂DAPI[产品货号:D523]共染色,可以更清楚地确认核仁。有关详细信息,请参阅使用说明书中的实验例。
原理
核仁是不带膜的核内结构体,也是核糖体生物合成的起点。核仁中存在许多核糖体RNA(rRNA),并且是 rRNA基因转录以及合成加工的场所。由于蛋白质合成的早期阶段在核仁中进行,因此核仁的变化被认为与多种细胞活动有关。核仁的形态变化已被公认为判断癌症的指标之一,近年来也有一系列的报道论述了核仁应激与DNA损伤、自噬、病毒感染和细胞衰老的关系,因此核仁在这些方面的研究也受到越来越多的关注。
核仁染色试剂的比较
| 最大激发波长 | 最大发射波长 | MeOH固定后染色 | PFA固定后染色 | 活细胞染色 | |
| Nucleolus Bright Green | 513 nm | 538 nm | 〇 | 〇 | △※ |
| Nucleolus Bright Red | 537 nm | 605 nm | 〇 | 〇 | △※ |
※希望通过活细胞进行评价时,请咨询公司技术支持。
产品特点
特点1:清晰地观察核仁
用4% PFA或MeOH固定HeLa细胞后,用PBS洗净后用1% Triton X-100进行破膜处理,加入Nucleolus Bright Green或Red和核染色
试剂 (DAPI) 并培养,然后用共聚焦荧光显微镜观察。
结果证实DAPI染色的细胞核内 (蓝色)有数个核仁存在。

<染色条件>
・PFA 固定
细胞在4%PFA室温下浸泡5 min,再用Triton X-100在室温下浸泡20 min,加入各种荧光探针后培养5 min。
・MeOH 固定
细胞在冷的MeOH中浸泡1 min,再用Triton X-100在室温下浸泡20 min,加入各种荧光探针后培养5 min。
| <检测条件> |
Nucleolus Bright Green Ex: 488 nm / Em: 500-600 nm
Nucleolus Bright Red Ex: 561 nm / Em: 565-650 nm
DAPI Ex: 405 nm / Em: 450-495 nm
特点2:核仁定位
用4%PFA固定WI-38细胞后,用抗Fibrillarin一抗和荧光标记的二抗免疫染色,并加入Nucleolus Bright Green或Red和核染色试剂
(DAPI) ,培养后,用落射式荧光显微镜 (Keyence,BZ-X710) 观察。
结果证实Nucleolus Bright Green和Nucleolus Bright Red与核仁标记物(Dense Fibrillar Component)的染色部位一致。

<检测条件>
Nucleolus Bright Green:Ex: 450-490 nm / Em: 500-550 nm
Nucleolus Bright Red:Ex: 533-548 nm / Em: 570-640 nm
DAPI:Ex: 340-380 nm / Em: 435-485 nm
Anti-Fibrillarin 抗体:Ex: 590-650 nm / Em: 668-733 nm
特点:3:与核仁相关的领域的报告示例
| 相关领域 | 概要 | 文献 | ||
| 评论(衰老) | 关于各种参与细胞功能的核仁, 包括与癌症和早老症的已知关系、 特别是关于衰老的核仁功能。 |
V. Tiku, A. Antebi, “Nucleolar Function in Lifespan Regulation.”, Trends Cell Biol., 2018, 28(8), 662. | ||
| 细胞衰老 | 由于与抑制衰老有关的蛋白质缺损、 核仁数量的减少和核仁总面积的加。 |
H. Tanaka, S. Takebayashi, A. Sakamoto, T. Igata, Y. Nakatsu, N. Saitoh, S. Hino, M. Nakao, “The SETD8/PR-Set7 Methyltransferase Functions as a Barrier to Prevent Senescence-Associated Metabolic Remodeling.”, Cell Rep.,2017, 18(9), 2148. | ||
| 细胞衰老 | 由于rRNA加工因子的枯竭导致 核仁肥大化, 同时SA-βGal和p16表达增加。 |
K. Nishimura, T. Kumazawa, T. Kuroda, N. Katagiri, M. Tsuchiya, N. Goto, R. Furumai, A. Murayama, J. Yanagisawa, K. Kimura, “Perturbation of ribosome biogenesis drives cells into senescence through 5S RNP-mediated p53 activation.”, Cell Rep., 2015, 10(8), 1310. | ||
| 自噬 | 通过抑制RNA聚合酶的转录, 确认自噬的诱导和核仁的形状变化。 |
N. Katagiri, T. Kuroda, H. Kishimoto, Y. Hayashi, T. Kumazawa and K. Kimura, “The nucleolar protein nucleophosmin is essential for autophagy induced by inhibiting Pol I transcription”, Scientific Reports, 2015, 8903, DOI: 10.1038/srep08903. | ||
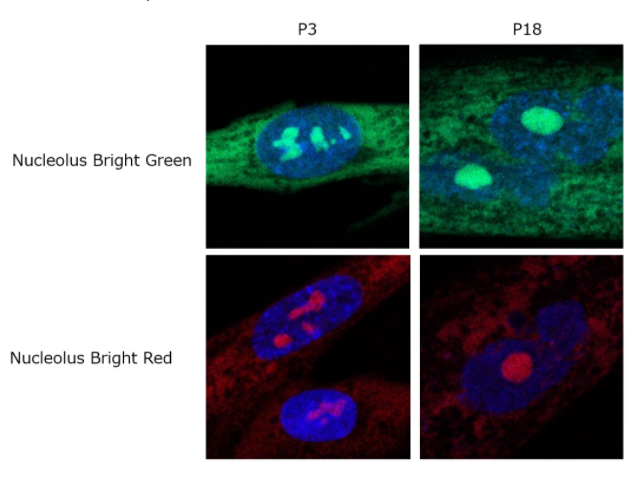
衰老细胞的评价例
将不同传代数的WI-38细胞用4% PFA固定后,用PBS洗净并用1% Triton X-100进行破膜处理,然后加入Nucleolus Bright Green或
Red和核染色试剂 (DAPI),培养后用共聚焦荧光显微镜观察。
结果证实第3代细胞 (P3) 中的一个细胞核内存在多个核仁,而第18代细胞 (P18) 中核仁变大并成为一体。
<染色条件>
细胞在4% PFA室温下浸泡5 min,再用Triton X-100在室温下浸泡20 min,加入各种荧光探针后培养5 min。
<检测条件>
Nucleolus Bright Green Ex: 488 nm / Em: 500-600 nm
Nucleolus Bright Red Ex: 561 nm / Em: 565-650 nm
DAPI Ex: 405 nm / Em: 450-495 nm
产品实验例
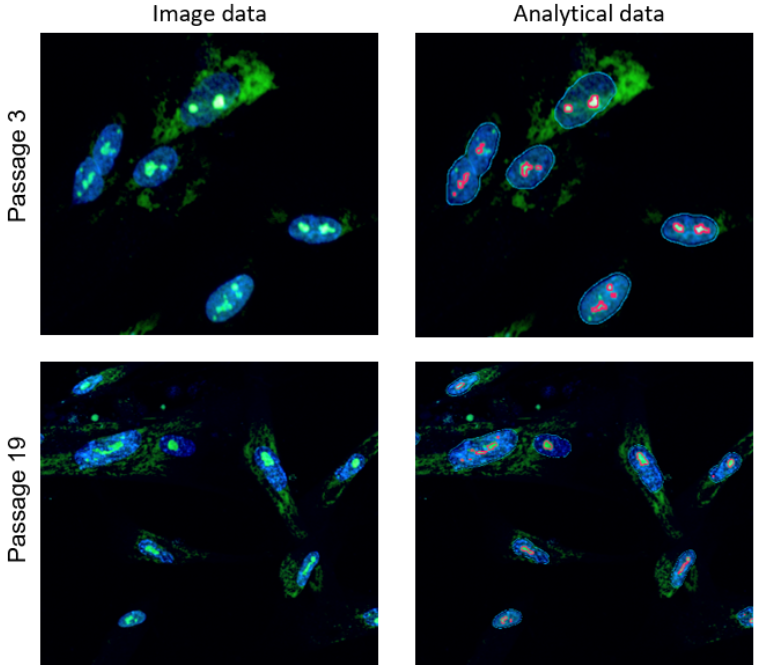
实验例:通过共聚焦定量细胞成像仪进行定量分析
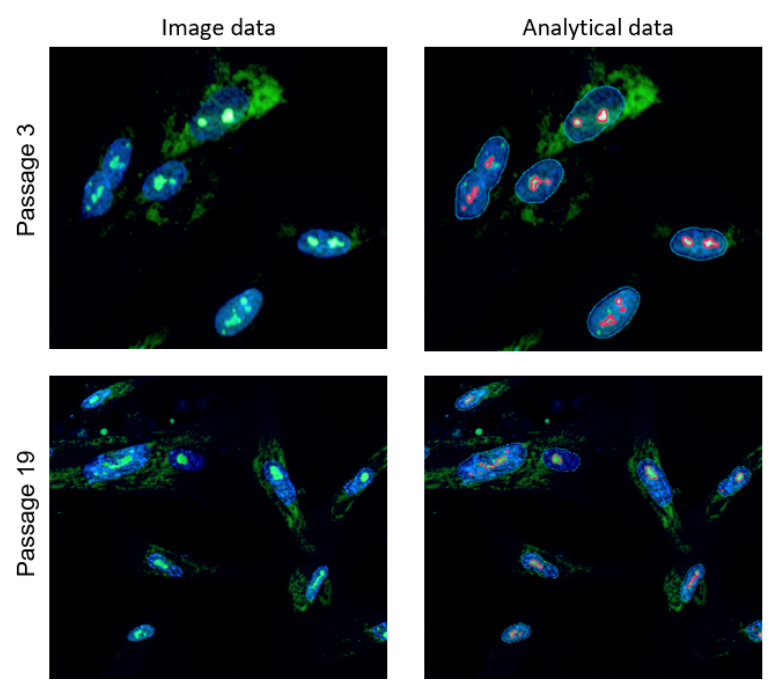
使用共聚焦定量细胞成像仪 (横河电机株式会社 CQ1)对衰老细胞的定量分析。
将传代数不同的WI-38细胞固定后,分别用Nucleolus Bright Green和DAPI染色核仁,并用共聚焦定量细胞成像仪进行定量分析
通过图像对核仁进行分析
用共聚焦定量细胞成像仪在405nm处拍摄细胞核图像,在488nm处拍摄核仁体像,通过分析软件Cell Pathfinder识别各个细胞核内的核仁,并计算出其数量。
横河电机CQ1拍摄条件
使用板:96孔板
物镜:40倍
激发波长:
405nm(DAPI):蓝色
488nm(Nucleolus Bright Green):绿色
视野:16视野
<解析图像>
蓝框线:核
红框线:核仁
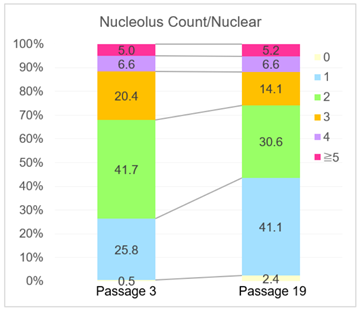
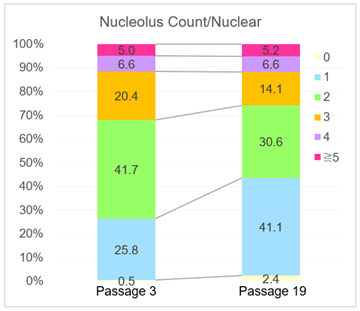
核仁数分析
在传代数较多的细胞中,得到了1个细胞核中只有1个核仁的比例增加,而2个及以上核仁的比例减少的结果。该结果与下述论文中衰老的WI-38细胞中核仁数的减少(论文中的Table3)*1,以及通过SETD8敲低诱导衰老的细胞核仁的变化(论文中的Figure4D)*2得到了相同的结果。
*1 P. M. Bemiller, L. Lee, “Nucleolar changes in senescing WI-38 cells”, Mech. Ageing Dev., 1978, 8 , 417.
*2 H. Tanaka, S. Takebayashi, A. Sakamoto, T. Igata, Y. Nakatsu, N. Saitoh, S. Hino, M. Nakao, “The SETD8/PR-Set7 Methyltransferase Functions as a Barrier to Prevent Senescence-Associated Metabolic Remodeling.”, Cell Rep., 2017, 18(9), 2148.
常见问题Q&A
| Q1:可以染色活细胞吗? |
| A1:本试剂建议用于固定细胞染色,不建议用活细胞染色。如果您想用活细胞染色,请联系我们的技术支持。 |