货号:D677
细胞自噬检测试剂盒
DAPRed – Autophagy Detection
储存条件:0-5度保存,避光
运输条件:室温
特点:
操作流程简便
与LC3结果高度一致
可以动态观察细胞自噬
关联产品TOP5
NO.1. DALGreen – Autophagy Detection 细胞自噬检测
NO.2. Cell Counting Kit-8 细胞增殖毒性检测
NO.3. Caspase-3 Assay Kit-Colorimetric- 细胞凋亡检测
NO.4. Liperfluo 细胞脂质过氧化物检测
NO.5. Mitophagy Detection Kit 线粒体自噬检测
产品概述
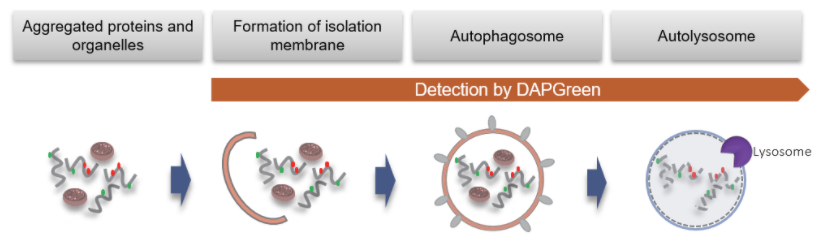
细胞自噬是细胞内损坏的蛋白质或细胞器降解和循环利用的过程。
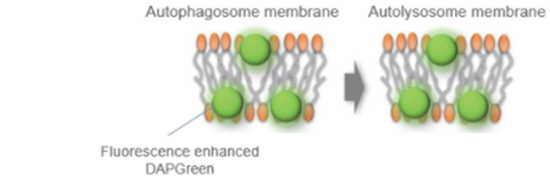
DAPRed是一种小分子荧光染料,可以用来检测自噬体及自噬溶酶体。由于其特殊的结构,在自噬体形成双层膜结构时染料可以进入其中,并在疏水环境中产生荧光。
DAPRed可以进入自噬体膜而发出荧光;而DALGreen可以在自噬溶酶体产生阶段发出荧光。因此DAPRed,DALGreen可以检测从自噬体的形成到自噬溶酶体的融合以及内容物分解的整个过程。
原理
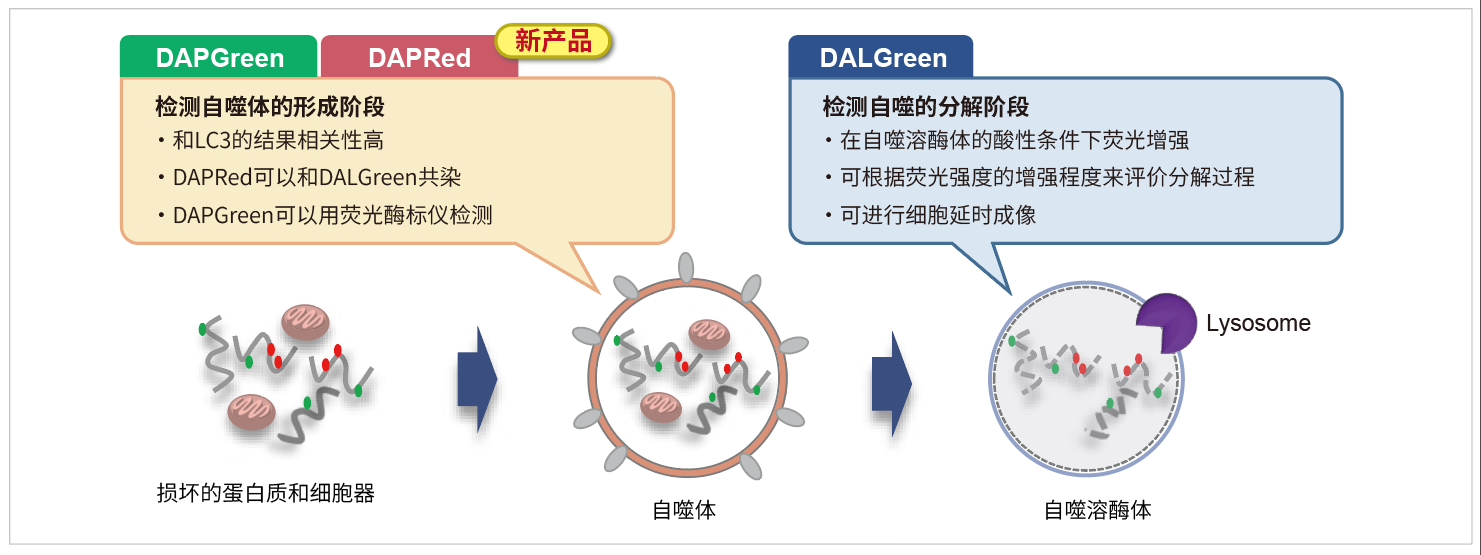
当形成自噬体膜时,DAPRed可以掺入其中,并在脂溶性环境中产生荧光。
DAPRed的检测结果与细胞自噬标志物LC3的结果有很高的相关性。

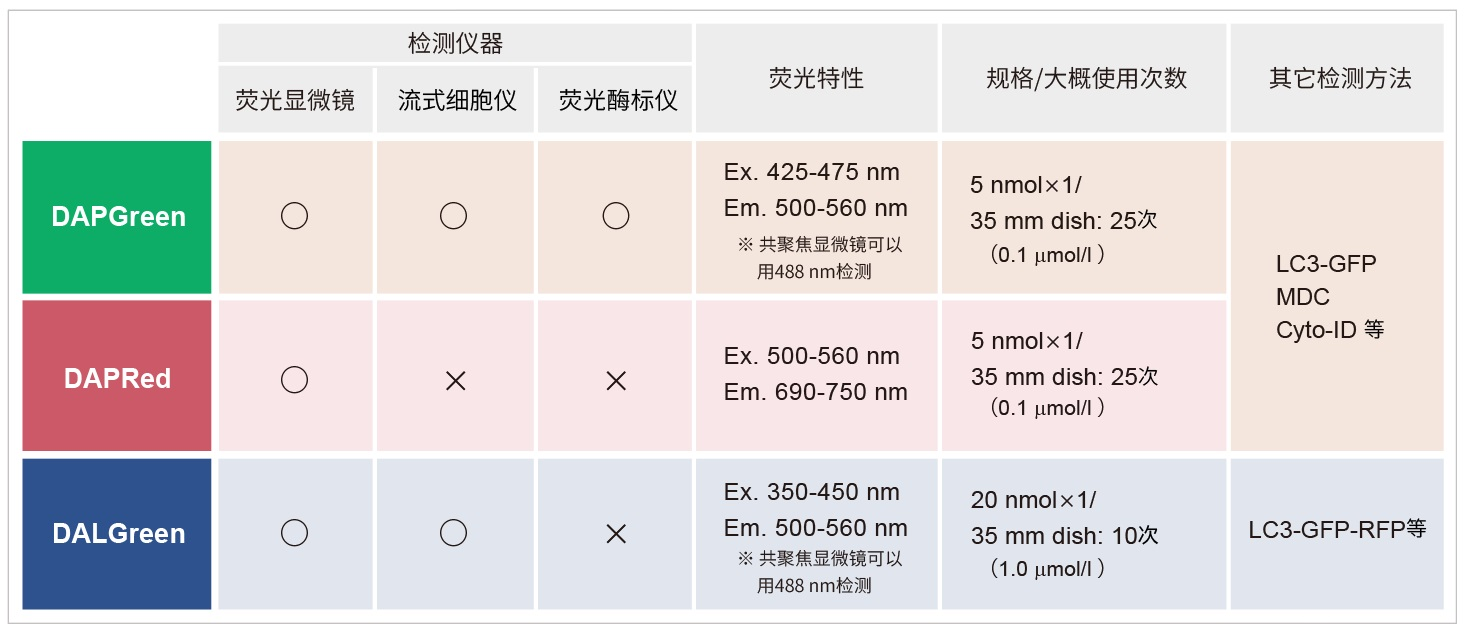
试剂概要
使用前,请确认所用仪器可以检测到的荧光特性。

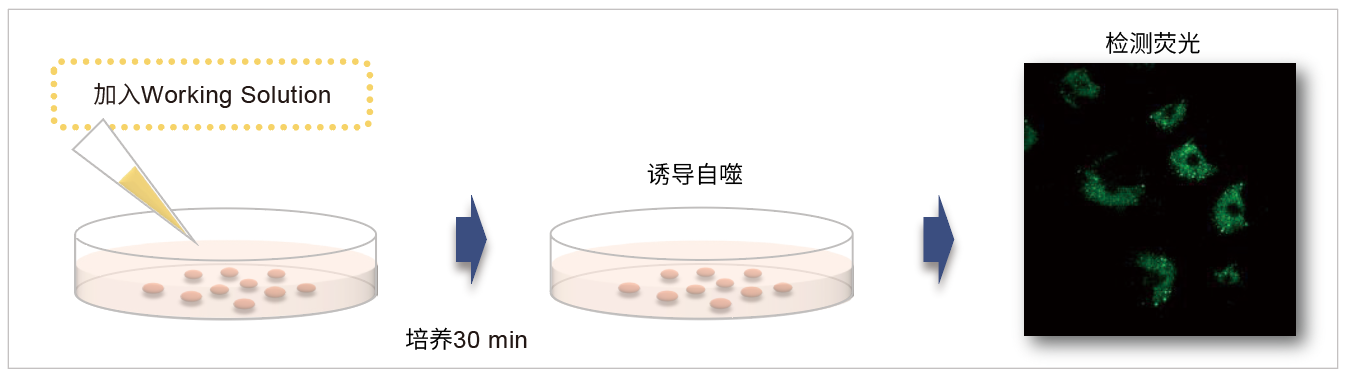
操作简便
操作流程只有一步-加入试剂
无需基因转染。只需向准备好的细胞加入DAPRed染料,即可方便快捷的进行荧光检测。

实验例
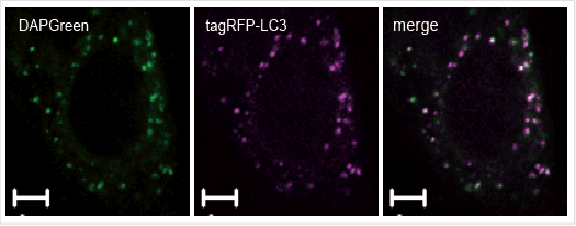
DAPRed和DAL Green的共染
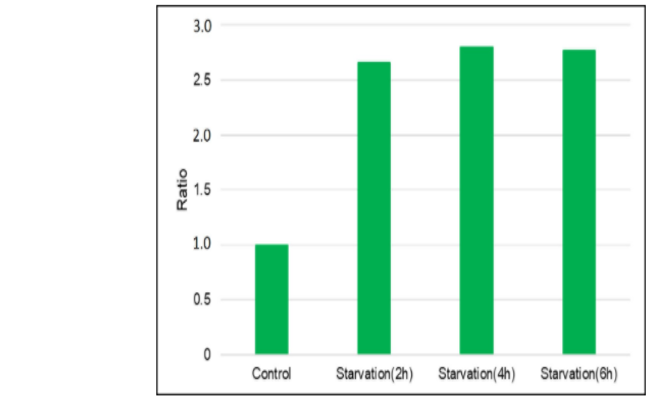
用自噬体荧光试剂DAPRed和自噬溶酶体荧光试剂DALGreen对HeLa细胞进行共染后,通过饥饿培养诱导自噬。

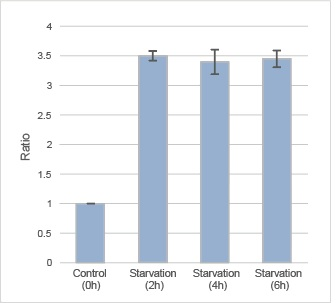
·结果
在不含氨基酸的培养基中培养的HeLa细胞,DAPRed和DALGreen荧光增强。
·检测条件
DAPRed:EX. 561 nm / Em. 600-700 nm
DALGreen:EX. 488 nm / Em. 500-563 nm
比例尺 :20 μm
·自噬诱导条件
用DAPRed和DALGreen染色后的HeLa细胞分别在增殖型培养基和不含氨基酸的培养基中培养5 h后,用共聚焦显微镜观察。
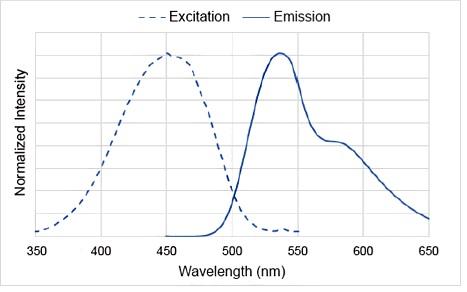
DAPRed荧光光谱

常见问题Q&A
Q1: DAPRed Working Solution的稳定性如何?
A1: 无法长期保存,需要现配现用
Q2: DAPRed DMSO Stocking Solution的稳定性如何?
A2: 配制后请于-20℃保存,一个月内可保持稳定。另外建议根据用量分装保存。
Q3: 推荐使用的滤光片?
A3: 推荐的滤光片如下:
激发波长:500-560 nm
发射波长:690-750 nm
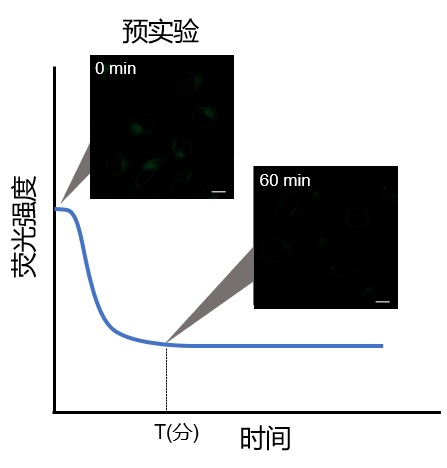
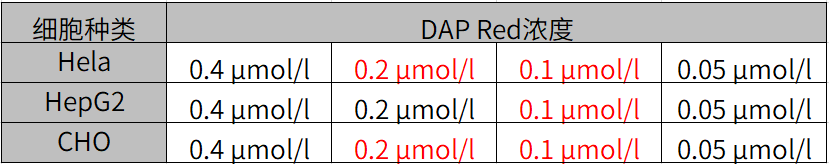
Q4: 如何确定细胞自噬探针DAPRed的最佳浓度?
A4:由于本试剂的特性,如果试剂的浓度太高或太低都会导致诱导自噬的样品组与未诱导自噬的对照组之间的差别不明显。建议参考以下信息摸索试剂的最佳浓度:
探针的最佳浓度根据细胞的种类而不尽相同。以DAPRed为例可以考虑从最低浓度(可以以0.05μmol/l作为参考)开始分别多个梯度至摸索至最高浓度(可以以0.4 μmol/l作为参考)的步骤进行摸索。
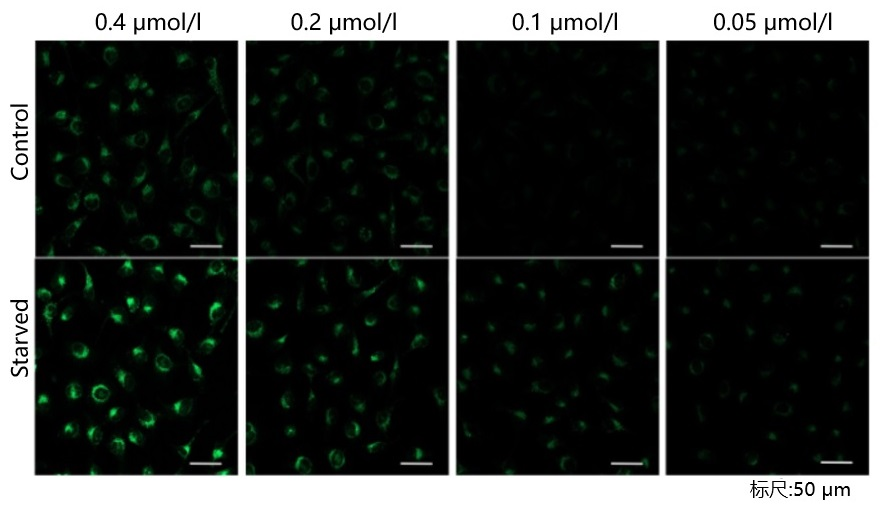
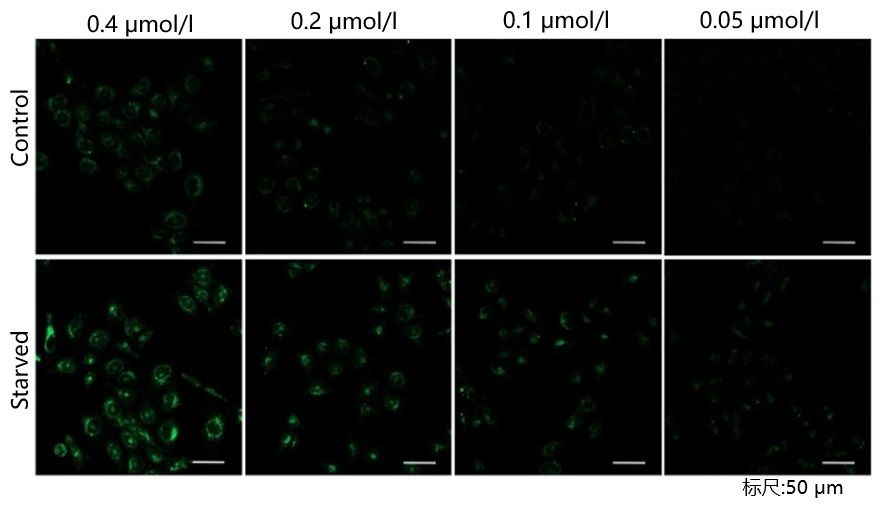
参考例
我们公司对HeLa, HepG2, CHO细胞的最佳浓度进行了摸索。DAPRed以下列浓度进行染色,并在无氨基酸的培养基中培养以诱导自噬。下表中红色字体的浓度可明显观察到实验组与空白组的差异。
[HeLa细胞]

[HepG2细胞]
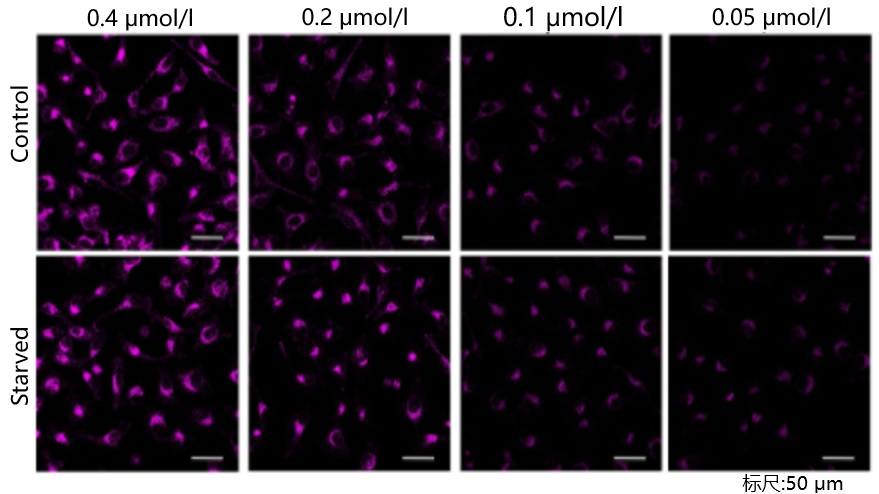
[CHO细胞]

<检测条件>放大倍率:20倍; 激发波长:Ex:561 nm;发射波长:Em:600-700 nm
Q5: 自噬有哪些途径?DAPRed可以检测到哪些状态?
A5: 众所周知,自噬根据其分子机制可以分为两种:一种是依赖于ATG5的传统自噬(LC3发生变化),另一种则是非依赖于ATG的选择性自噬(LC3形式的转化并未发生)。
当形成自噬体膜时,DAPRed可以掺入其中,并在脂溶性环境中产生荧光。因此DAPRed可以检测自噬体的状态。
*参考资料:发现新的自噬机制Shigeomi Shimizu
https://www.dojindo.co.jp/letterj/160/review/01.html
文献链接:http://dx.doi.org/10.14348/molcells.2018.2215
▶对于首次检测的细胞类型和实验条件,请参考FAQ[如何确定细胞自噬探针DAPRed的最佳浓度]。
参考文献
|
No. |
检测样品 |
检测仪器 |
引用(含链接) |
|
1) |
细胞 |
荧光显微镜 |
X. Chen, X. Yan, J. Liu and L. Zhang, ” Chaiqi decoction ameliorates vascular endothelial injury in metabolic syndrome by upregulating autophagy.”, Am. J. Transl. Res., 2020,12(9), 4902. |
|
2) |
细胞 |
荧光显微镜 |
H. Fang , S. Geng, M. Hao, Q. Chen, M. Liu, C. Liu, Z. Tian, C. Wang, T. Takebe, J-L Guan, Y. Chen, Z. Guo, W. He and J. Diao, “Simultaneous Zn2+ tracking in multiple organelles using super-resolution morphology-correlated organelle identification in living cells “, Nat Commun, 2021, 12(1), 109. 10.1016/j.envpol.2019.07.105. |
|
3) |
细胞 |
荧光显微镜 |
H. Sun, R. Wang, Y. Liu, H. Mei and X. Liu , “USP11 induce resistance to 5-Fluorouracil in Colorectal Cancer through activating autophagy by stabilizing VCP”, J Cancer , 2021, 12(8), 2317. |
|
4) |
细胞 |
荧光显微镜 |
M. Yagi, T. Toshima, R. Amamoto, Y. Do, H. Hirai, D. Setoyama, D. Kang and T. Uchiumi, “Mitochondrial translation deficiency impairs NAD+-mediated lysosomal acidification”, EMBO J, 2021, doi:10.15252/embj.2020105268. |