免疫组织化学(IHC)是一种染色程序,AAT Bioquest抗原,AAT Bioquest代理,样品制备对于在 IHC 中产生高质量染色至关重要。如果操作正确,它将在实验过程中保持细胞形态、组织结构和目标表位的抗原性。
免疫组织化学 (IHC) 是一种众所周知的染色程序,它使用抗体在组织结构的范围内检测和定位感兴趣的蛋白质,例如抗原。该技术被广泛用作临床诊断中的辅助方法,以定位和量化与各种疾病,特别是癌症相关的异常蛋白质表达。借助特定的肿瘤标志物,研究人员可以确定肿瘤的恶性程度、分期和分级,以及识别和分类未知原发部位的转移性癌。在基础研究中,IHC 用于研究正常组织和器官发育、组织修复、伤口愈合以及探索和验证关键生物标志物。虽然 IHC 染色有很多变化,包括 IHC 冷冻、IHC 石蜡和无 IHC 浮动,但每种方法的工作流程是相似的。
样品制备
样品制备对于在 IHC 中产生高质量染色至关重要。如果操作正确,它将在实验过程中保持细胞形态、组织结构和目标表位的抗原性。样品制备涉及几个步骤,包括固定、脱水、包埋、切片和抗原修复。
组织固定
组织固定负责保持组织形态和靶分子的抗原性。使用基于甲醛或酒精的固定剂进行固定,所用固定剂的类型受待染色的目标抗原和所需的检测技术(即荧光或显色)的影响。甲醛是用于保存蛋白质靶标的最广泛使用的固定剂。它可用于任何时间长度的灌注和浸入固定技术。但是,应仔细优化持续时间和其他固定条件,因为它们会影响保存和组织完整性。例如,用甲醛过度固定会掩盖表位并产生强烈的非特异性染色,而固定不足可能会降低或消除组织的免疫反应性。在甲醛中固定后,
用于组织固定的最常见的醇是乙醇和甲醇。当添加到样品中时,酒精固定剂会破坏蛋白质氢键,改变它们的三级结构和水溶性,导致蛋白质沉淀。与基于甲醛的固定剂相比,醇类更能保持抗原性。它们更适合检测膜结合蛋白和研究 DNA、RNA 和翻译后修饰,如磷酸化。由于酒精的渗透性不如甲醛,它们主要用于在切片后固定冷冻组织样本。
组织嵌入、切片和安装
嵌入是 IHC 的重要组成部分,因为它保留了组织形态并在切片期间提供组织支持。经甲醛固定的组织通常会脱水,包埋在石蜡中,然后使用切片机切成 4 到 5 µm 的切片。然后将这些切片安装在涂有组织粘合剂(3-氨基丙基三乙氧基硅烷 (APTS)、聚-L-赖氨酸)的载玻片上,在烤箱或微波炉中干燥过夜,并在室温下长期储存。染色前,必须对福尔马林固定的石蜡包埋 (FFPE) 组织进行去石蜡处理,并且应执行抗原修复步骤以恢复在固定过程中被掩盖的抗原位点。
对化学固定或脱蜡过于敏感的组织样本可以通过将组织浸入液氮或异戊烷中进行速冻。这对于保存天然状态的蛋白质和检测翻译后修饰特别有用。已冷冻的组织在低温恒温器上切成 5 至 20 µm 厚的切片,并安装在涂有粘合剂的载玻片(明胶、聚 L-赖氨酸)上。冷冻组织载玻片可在 -80 °C 下安全保存 6 至 12 个月。在实验当天,在染色前将冷冻组织切片在酒精中固定十分钟。由于酒精固定剂不会掩盖表位,因此不需要抗原修复步骤。
|
石蜡包埋组织 |
冷冻组织 |
| 固定 |
在包埋在石蜡中之前,组织样本在甲醛中固定。 |
组织样品通过浸入液氮或异戊烷中速冻,然后在酒精中固定。 |
| 切片仪器 |
切片机 |
低温恒温器 |
| 贮存 |
在室温下稳定多年 |
-80°C 保存 12 个月 |
| 好处 |
- 保留组织形态
- 具有成本效益的环境存储条件
- 最适合组织归档
|
- 更快的方案不需要去石蜡或抗原修复步骤
- 保留酶和抗原功能
- 不需要像 FFPE 组织那样的初始固定步骤
|
| 限制 |
|
|
脱蜡和表位检索
去石蜡过程去除包埋在组织中的石蜡,并用水溶液使组织再水化,为 IHC 染色做准备。未能去除 FFPE 切片中的石蜡会阻止抗体与其目标抗原发生反应,从而导致染色质量差。为使 FFPE 组织脱蜡,首先将载玻片加热至 55 °C 十分钟以熔化蜡。接下来,执行几个洗涤步骤以去除石蜡并再水化组织。这些包括:
- 用二甲苯多次洗涤以溶解和去除石蜡
- 用二甲苯和乙醇分级洗涤以去除二甲苯
- 通过在水中分级浓度的乙醇对样品进行再水合
- 最后用纯水冲洗以去除乙醇
脱石蜡后,抗原修复方法用于恢复在甲醛固定过程中被掩盖的抗原表位。FFPE 组织的两种抗原修复方法包括热诱导表位修复 (HIER) 和蛋白水解诱导表位修复 (PIER)。HIER 是最常用的抗原修复方法。它需要在预热的修复溶液中将载玻片加热到 95 °C 几分钟,例如柠檬酸盐(10 mM 柠檬酸,0.05% Tween 20,pH 6.0),EDTA(1 mM EDTA,0.05% Tween 20,pH 8.0) 或 TBS (50 mM TBS, 0.05% Tween 20, pH 9.0) 缓冲液。加热后,将载玻片冷却至室温,然后在染色前用去离子水和 PBS 轻轻冲洗。HIER 可以使用各种加热设备,例如电炉、微波炉、压力锅、烤箱或蔬菜蒸锅。每个都有其提到的工作流程的变化。因此,最佳 HIER 条件应由个别调查人员确定。
PIER 方法使用蛋白酶(例如胰蛋白酶 (0.05%) 或蛋白酶 K (20 µg/mL))来部分消化蛋白质并揭示抗原表位。这种方法需要仔细优化最终酶浓度、孵育温度和孵育时间。未能优化这些条件会显着降低恢复免疫反应性并破坏组织形态和抗原完整性的成功率。
组织样本标签
组织标记是一个多步骤的过程,它使用抗体来检测和可视化目标抗原。它涉及淬灭内源蛋白的活性、阻断非特异性结合位点、靶蛋白的免疫检测、复染(可选)和信号生成。为了最大化信号检测和减少背景干扰,每个步骤的优化都至关重要。研究人员必须仔细考虑他们的标记策略(直接或间接)、检测方法(显色或荧光)以及执行实验设计所需的试剂。
淬灭内源性蛋白质活性
组织含有几种内源性蛋白质,例如过氧化物酶、磷酸酶和生物素。如果管理不当,这些蛋白质的活性可能会干扰抗原检测和染色过程,从而导致假阳性和显着的高背景干扰。在用一抗孵育组织样本之前,研究人员必须首先确定哪些内源性成分会干扰信号检测,然后使用适当的封闭试剂消除干扰。确定要淬灭的内源性成分最终与与产生信号的抗体偶联的标签类型有关。例如,使用酶标签辣根过氧化物酶 (HRP) 的方案可能需要用过氧化氢阻断以抑制内源性过氧化物酶活性并提高灵敏度。
| 如果使用 |
堵塞 |
组织类型 |
阻塞方法 |
| 生物素化抗体 |
生物素 |
肝、肾、心脏、脑、肺、乳腺和脂肪组织 |
要阻断内源性生物素,首先,将组织样本与链霉亲和素一起孵育。由于链霉亲和素是四聚体,最多可以结合四个生物素分子,因此需要随后用游离生物素进行孵育以阻断剩余的未占用的生物素结合位点。 |
| HRP标记的抗体 |
过氧化物酶 |
肝脏、肾脏和血管区域有红细胞 |
在一抗孵育之前,可以通过与ABTS或TMB孵育来测试组织的内源性 HRP 。如果分别观察到蓝绿色或蓝色,则存在 HRP,需要进行封闭。在 3% 过氧化氢中孵育组织切片 10 分钟以淬灭内源性过氧化物酶活性。然后用 PBS 清洗 3 次。对于精细样品,3% 的过氧化氢可能会损坏切片或改变表位的可及性,请尝试 0.3% 的较低浓度。 |
| AP标记的抗体 |
磷酸酶 |
肠、肾、成骨细胞、淋巴组织和胎盘 |
在一抗孵育之前,可以通过与底物 NBT/BCIP 孵育来测试组织的内源性 AP;如果观察到蓝色,则存在 AP,并且需要阻塞。使用 1 mM 左旋咪唑淬灭内源性磷酸酶活性;这是与显色底物一起添加的。对于肠道AP,左旋咪唑无效。在初级抗体孵育前用 1% 乙酸阻断肠道 AP。 |
阻止非特定交互
控制抗体-抗原检测的相同吸引力,例如疏水相互作用、离子相互作用和其他分子间作用力,也可能导致抗体非特异性弱结合到模拟靶抗原上正确结合位点的位点。如果管理不善,非特异性相互作用会导致高背景干扰,从而阻止感兴趣的抗原在其组织结构中的可视化。非特异性结合的常见原因包括抗体或其他检测试剂与血清蛋白的相互作用以及抗体与组织之间的离子相互作用。
为了减轻非特异性相互作用,应在样品制备后和与一抗孵育之前进行封闭步骤。通常,任何不与抗体或靶抗原结合的蛋白质都可用于阻断非特异性疏水相互作用。常见的例子包括牛血清白蛋白 (BSA)、明胶、脱脂奶粉或来自与二抗相同物种的血清。如果使用多种二抗染色,则需要针对所有使用过的二抗封闭血清。一抗和二抗的稀释剂中通常包含以 1-5% (w/v) 终浓度添加的含有 BSA、明胶或脱脂奶粉的封闭缓冲液。此外,非离子洗涤剂包括0.3% Triton X-100™或 Tween 20™ 也可以减少非特异性疏水相互作用。
免疫标记组织样本
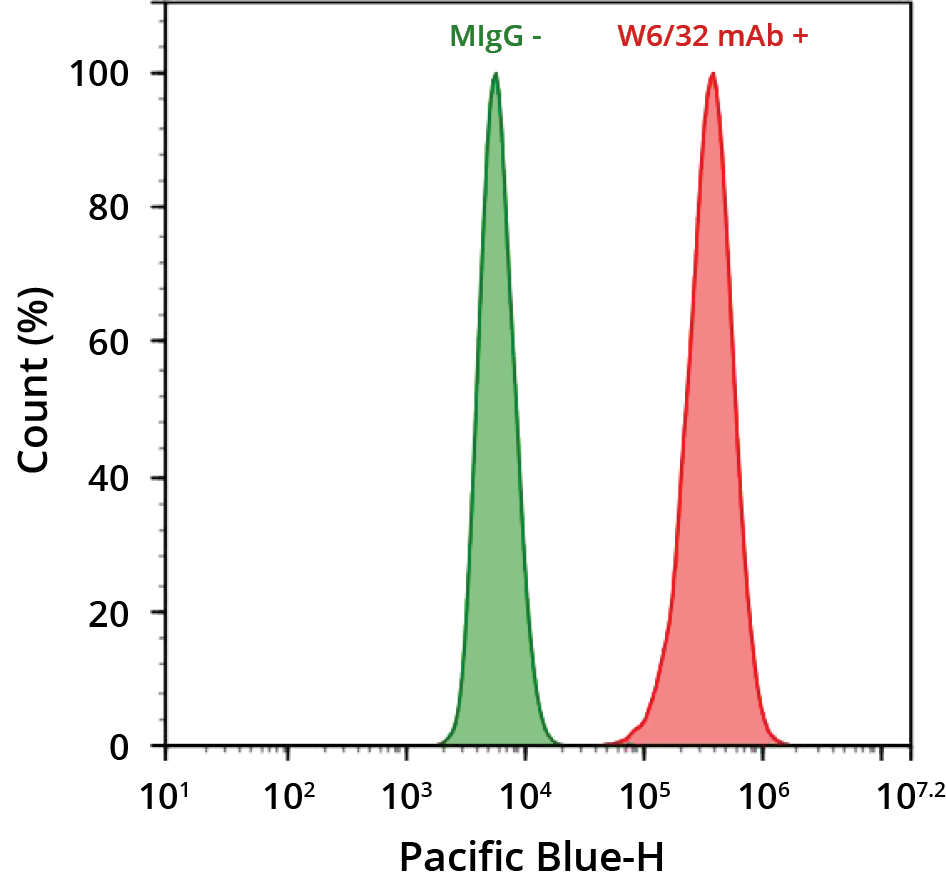
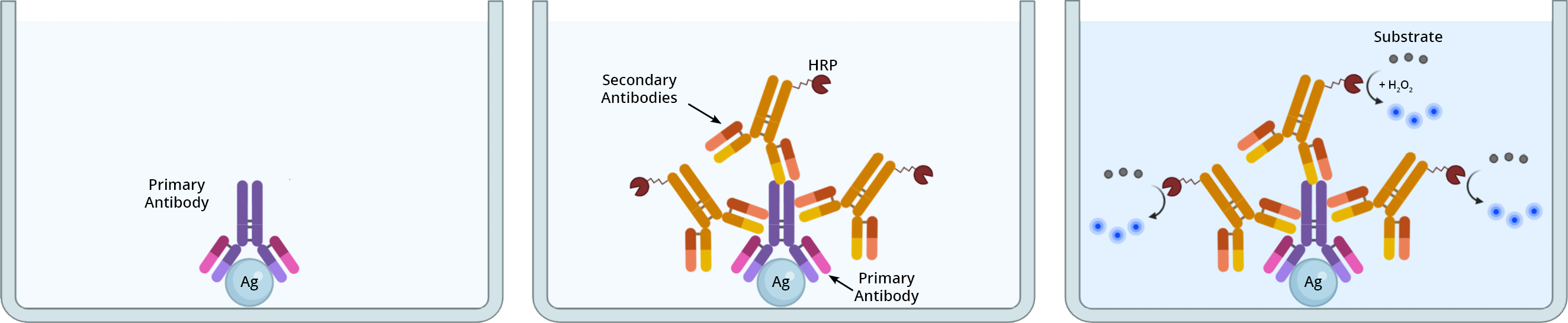
可以使用直接或间接检测方法用抗体检测目标抗原(图 1)。确定使用哪种检测方法取决于目标抗原的表达水平、其可及性以及所需的读数类型。然而,每一步的优化将有助于最大限度地提高信号检测。
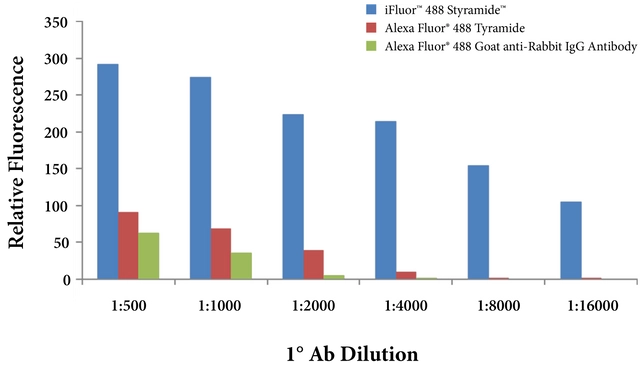
直接检测方法通常用于检测高表达抗原。针对目标抗原的一抗直接与报告酶(例如,HRP 或 AP)或荧光团偶联,以促进检测和可视化。酶标记抗体通常用于显色检测,需要随后与合适的底物孵育以产生信号,例如TMB、ABTS或ReadiUse™ StayRight™ PurpleDAB 的更安全的非诱变替代品。底物和酶之间的反应导致在抗原定位部位沉淀出不溶的有色沉淀物,在光学显微镜下可以观察到。对于荧光检测,一抗与荧光团(例如 iFluor™ 染料)偶联并在荧光显微镜下观察。
在间接检测中,一抗和二抗都用于检测感兴趣的目标。未缀合的一抗直接与靶标结合,而与报告酶或荧光团缀合的二抗与一抗结合。标记的二抗通常针对一抗种类的免疫球蛋白类别或亚类。例如,在兔体内产生的一抗需要在兔以外的宿主物种中产生的抗兔二抗(例如山羊抗兔二抗)。)。间接检测的一个主要优点是它能够放大检测信号,这可以通过多种二抗与单一一抗的结合来实现。灵敏度的显着提高使间接检测方法最适合检测低丰度目标。其他与 IHC 兼容的信号放大间接检测方法包括PSA™ 信号放大、亲和素-生物素复合物 (ABC) 和标记的链霉亲和素生物素 (LSAB) 方法。
未标记的一抗和二抗、它们各自的偶联物和酶底物可以直接从 AAT Bioquest® 订购。此外,可以使用商业提供的标记试剂盒直接标记抗体,例如我们用于荧光团偶联的ReadiLink™ 快速抗体标记试剂盒或我们的Buccutite™ HRP 和 Poly-HRP 抗体标记试剂盒。
反染色
在使用抗体标记目标抗原后,通常会在切片上应用第二种化学染色剂,以突出特定的组织结构并增加主要染色剂的对比度。选择复染剂时,重要的是要选择光谱上不与主要染色剂重叠的复染剂。这将最大限度地减少渗漏效应并提高每个信号的可辨别性。单核复染剂如苏木精、核固红和甲基绿常用于显色检测方法。对于荧光检测方法,目标特异性荧光团用于对细胞核、细胞骨架成分、淀粉样蛋白沉积物和其他组织结构进行复染。这些包括 DNA 结合染料,例如DAPI、Hoechst和核 LCS1/DCS1™ 染料(见下表 1)、用于染色 F-肌动蛋白的鬼笔环肽偶联物和淀粉样蛋白染色剂(如刚果红)。

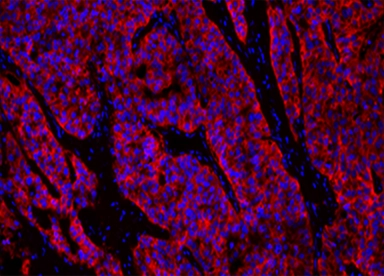
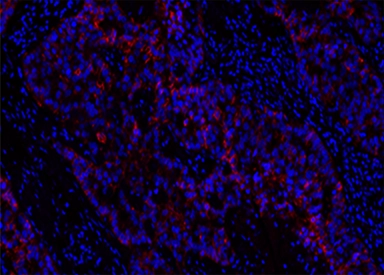
甲醛固定石蜡包埋 (FFPE) 乳腺癌组织中 HER2/ErbB2 的荧光免疫组织化学分析。将人 Her2/Neu (c-erbB-2) 阳性组织切片与小鼠 mAb HER2/ErbB2 以 1:5000 的稀释度孵育,然后用带有山羊抗小鼠 IgG 的 iFluor™ PSA™ 成像试剂盒染色。使用Nuclear Blue™ DCS1 对细胞核进行复染。