货号:M489
铁死亡荧光试剂 (Fe2+荧光法)
Mito-FerroGreen
储存条件:-20度保存,避光
运输条件:室温
特点:
定位线粒体
更深层次铁离子探究
选择规格:50μg*2

关联产品TOP5
NO.1. FerroOrange 细胞亚铁离子检测
NO.2. Liperfluo 细胞脂质过氧化物检测
NO.3. MitoPeDPP 线粒体内脂质过氧化物检测
NO.4. Cell Counting Kit-8 细胞增殖毒性检测
NO.5. GSSG/GSH Quantification Kit II 氧化型/还原型谷胱甘肽
产品概述
研究证实铁是生物体内量最多的过渡金属元素。其参与多种生理活动。近几年,细胞内的游离铁离子由于具有很高的反应性,和细胞损伤、死亡有一定的关联而得到了越来越多的关注。在细胞内游离铁离子以稳定的Fe2+和 Fe3+形式存在。从细胞内的还原环境,金属转运体及Fe2+的水溶性考虑,认为揭示细胞内Fe2+的行为比Fe3+更重要。Mito-FerroGreen是一种新型荧光探针,用于检测线粒体 (铁硫簇和血红素蛋白的合成场所) 内亚铁离子Fe2+。
该产品已在岐阜药科大学药物化学实验室的 永澤秀子 和 平山祐 博士的指导下开发。
测定原理
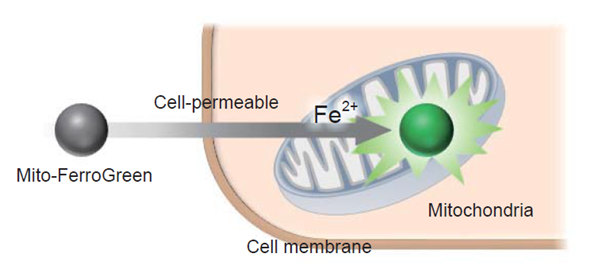
产品特点
铁离子检测试剂的选择
可以根据自己的实验方法和实验仪器选择检测试剂
| FerroOrange | Mito-FerroGreen | |
| 细胞内分布 | 细胞内 | 线粒体 |
| 荧光特性 | λex : 543 nm、λem : 580 nm | λex : 505 nm、λem : 535 nm |
| 检测仪器 | 荧光显微镜 | 荧光显微镜 (FITC、GFP) |
| (滤镜) | ||
| 检测对象 | 活细胞 | 活细胞 |
| 染色次数 | 24 μg可染色35 mm dish 17块板 | 50 μg可染色35 mm dish 5块板 |
| (终浓度 1 μmol/l時) | (终浓度 5 μmol/l時) |
实验例
1.线粒体定位
为了确认Mito-FerroGreen的是否特异性地在线粒体内定位,与线粒体染色试剂(MitoBright Deep Red※)一同进行染色,实验结果证实了Mito-FerroGreen选择性地染色在线粒体内。
向HeLa细胞中添加5μmol/ l的Mito-FerroGreen和200 nmol/l的线粒体染色探针MitoBright Deep Red,并在CO2培养箱中培养30分钟,然后添加100μmol/ l的硫酸铁铵(II),并将混合后的细胞溶液在CO2培养箱中培养1小时后通过观察荧光。
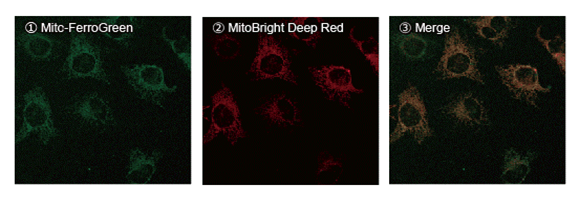
Mito-FerroGreen
激发波长:488 nm
发射波长:500-565 nm
MitoBright Deep Red
激发波长:640 nm
发射波长:656-700 nm
2.线粒体内的铁离子荧光成像
在含有血清的MEM培养基中接种HeLa细胞,并加入Mito-FerroGreen,通过荧光检测HeLa细胞众线粒体内的二价铁(左图)。而在添加了铁离子的HeLa细胞中,观察到了Mito-FerroGreen的荧光明显增强(中间图)。在添加了铁螯合剂的细胞中,几乎未观察到Mito-FerroGreen的荧光(右图)。 以这种方式,证实了线粒体中铁含量的差异和荧光强度的差异是成相关性的。

3.对二价铁离子的高度选择性和高信号
向1ml 50mmol/l HEPES Buffer(pH7.4)中加入2μl 1mol/l Mito-FroGreen、2μl 10mmol/l各种金属以及20μl 1mg/ml酯化酶,在室温下反应1小时后测定荧光强度。
激发波长:500 nm
发射波长:535 nm

4.适用于通用滤光片
Mito-FerroGreen的激发波长为488nm,最大激发波长可达505nm。
向3ml 50 mmol/l HEPES Buffer (pH7.4) 中加入 6μl 1mol/l Mito-FroGreen、6μl 10mmol/l硫酸铵铁(Ⅱ)以及20μl 1mg/ml酯化酶。在37℃下反应1小时后检测荧光强度。
激发波长:500 nm
发射波长:535 nm

常见问题Q&A
Q1:是否可以对酵母进行染色吗?
A1:我们公司有酵母染色的实验例,染色的具体实验步骤请联系我们公司的销售人员。
Q2:推荐使用的滤光片波长是多少?
A2:检测时推荐的滤光片如下:
激发波长:450~500 nm
发射波长:515~550 nm
规格性状
性状:本品溶于乙腈、甲醇、二甲醇。
纯度(HPLC):90.0%以上
荧光光谱:适合测试
参考文献
1) T. Hirayama, S. Kadota, M. Niwa and H. Nagasawa, “A mitochondria-targeted fluorescent probe for selective detection of mitochondrial labile Fe(II)”, Metallomics., 2018, DOI: 10.1039/C8MT00049B
2) T. Issitt, E. Bosseboeuf, N. Winter, N. Dufton, G. Gestri, V. Senatore, A. Chikh, A. Randi, C. Raimondi, “Neuropilin-1 controls endothelial homeostasis by regulating mitochondrial function and iron-dependent oxidative stress via ABCB8”, iScience., 2018,DOI: 10.1016/j.isci.2018.12.005 .
3) E. E. Mon, F. Y. Wei, R. N. R. Ahmad, T. Yamamoto, T. Moroishi and K. Tomizawa, “Regulation of mitochondrial iron homeostasis by siderofexin 2 “, J Physiol Sci., 2018,doi:10.1007/s12576-018-0652-2.
4) M. Fujimaki, N. Furuya, S. Saiki, T. Amo, Y. Imamichi and N. Hattori, “Iron supply via NCOA4-mediated ferritin degradation maintains mitochondrial functions”, Mol. Cell. Biol.., 2019,doi: 10.1128/MCB.00010-19.
5) K. Tomita, M. Fukumoto, K. Itoh, Y. Kuwahara, K. Igarashi, T. Nagasawa, M. Suzuki, A. Kurimasa and T. Sato, “MiR-7-5p is a key factor that controls radioresistance via intracellular Fe2+ content in clinically relevant radioresistant cells.”, Biochem Biophys Res Commun.., 2019,doi: 10.1016/j.bbrc.2019.08.117.
6) Y. Wang and M. Tang, “PM2.5 induces ferroptosis in human endothelial cells through iron overload and redox imbalance”, Environ. Pollut., 2019, 264, doi: 10.1016/j.envpol.2019.07.105.
7) KF. Yambire, C. Rostosky, T. Watanabe, D. Pacheu-Grau, S. Torres-Odio,A. Sanchez-Guerrero,O. Senderovich, EG. Meyron-Holtz,I.Milosevic, J. Frahm, AP. West and N. Raimundo, “Impaired lysosomal acidification triggers iron deficiency and inflammation in vivo.”, Elife, 2019, 3, (8), doi:10.7554/eLife.51031.
8) H. Nishizawa, M. Matsumoto, T. Shindo, D. Saigusa, H. Kato, K. Suzuki, M. Sato, Y. Ishii, H. Shimokawa and K. Igarashi, “Ferroptosis is controlled by the coordinated transcriptional regulation of glutathione and labile iron metabolism by the transcription factor BACH1″, J. Biol. Chem., 2019,doi: 10.1074/jbc.RA119.009548.
9)Y. akashima, A. Hayano and B. Yamanaka, Metabolome analysis reveals excessive glycolysis via PI3K/AKT/mTOR and RAS/MAPK signaling in methotrexate-resistant primary CNS lymphoma-derived cells.”, Clin. Cancer Res., 2020, DOI:10.1158/1078-0432.







