转染胺™ mRNA转染试剂
AAT代理,转染胺™ mRNA转染试剂,微信同号 18301939375,部分现货,欢迎来电咨询
上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
ViaFect™ Transfection Reagent(新型转染试剂)
目录价:
货号
品牌
产品线
特点:
·脂质体转染试剂,毒性低
·胞慢病毒转染率高
·实验案例丰富

凑单关联产品TOP5
NO.1. Cell Counting Kit-8 细胞增殖毒性检测
NO.2. Annexin V, FITC Apoptosis Detection Kit 细胞凋亡检测
NO.3. Caspase-3 Assay Kit-Colorimetric- 细胞凋亡检测
NO.4. Annexin V, 633 Apoptosis Detection Kit 细胞凋亡检测
NO.5. Cytotoxicity LDH Assay Kit-WST 乳酸脱氢酶(LDH)检测
试剂盒内含
1 ml HilyMax Reagent 1 tube×1
Lipoform Buffer 1.0 mL×1
产品概述
HilyMax 是Dojindo公司研发的一种新型阳离子脂质体基因转染试剂,可用于高效转染多种细胞系及siRNA。HilyMax具有不受培养基中血清影响,转染过程不需更换培养基等特点。另外HilyMax试剂中不含影响转染效率的成分。
产品特性
应用:基因转染
特点:
1.实验操作简单
2.可用于贴壁细胞和悬浮细胞的瞬转及稳转。
3.适用于含血清的的培养基,毒性低,转染效率高且稳定。
4.适用于SiRNA的转染实验。
5.与同类进口产品相比,价格较低。
订购前请来电咨询各细胞系的相关条件优化
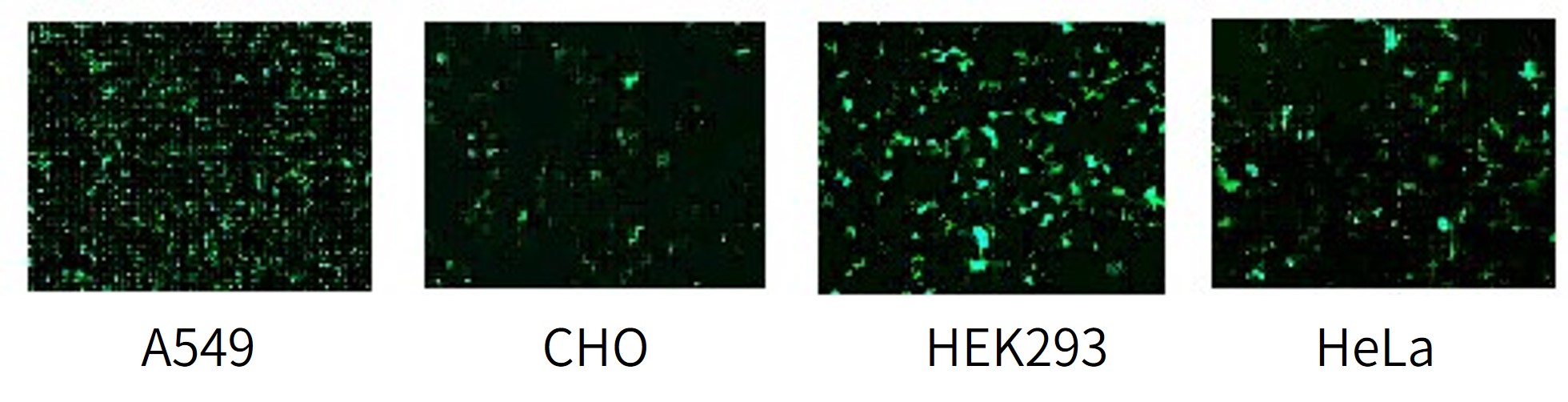
各细胞系GFP转染实例
实验操作
基本操作:转染步骤(24孔板)a)
1.细胞准备
贴壁细胞:转染前一天,调整细胞浓度在0.5 ml的培养基中预先接种40%-90%的汇合细胞b),转染前将细胞悬液接种至24孔板。
悬浮细胞:转染前一天,调整细胞浓度至每0.5 ml的培养基中0.1-1.6×106的细胞,细胞悬液接种至24孔板。
2.形成DNA-HilyMax转染复合物c)
添加不含血清的培养基至消毒离心管。d)
添加质粒DNA(0.5-1,5μg)至离心管,使用移液器充分混合。
添加HilyMax至离心管,使用移液器充分混合,推荐的DNA(μg)与HilyMax的使用比率为1:2-1:6。
在室温下培养15分钟 e)

3.添加转染复合物至细胞:在步骤1准备好的培养板上,每孔中添加DNA-HilyMax转染复合物。
4.培养:在37℃下放置于CO2培养箱培养。f)
5.检测:确保转染后24至72小时,基因的活性
a)实验用量需要根据培养板大小而改变,请参考说明书“不同培养板转染状况”部分。
b)培养基中血清成分不会影响转染效果。
c)DNA及HilyMax的参考密度见表1。
d)培养基中的血清及抗生素会影响DNA-HilyMax转染复合物的形成。Opti-MEM, DMEM和MEM不会影响转染效果,请使用其他培养基来检验转染效率。
e)培养时间超过30分钟会造成转染效率偏低。
f)转染后更换培养基可以有效地提高转染效率,降低某些细胞系的毒性。
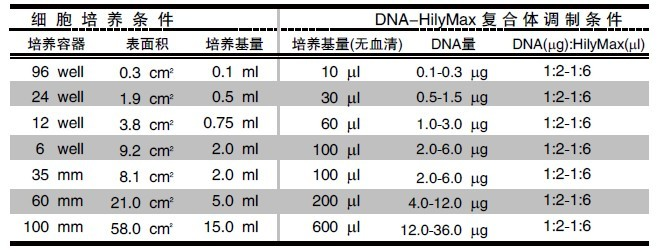
转染复合物中DNA与HilyMax的使用量:
表1:表明了不同细胞密度下推荐的DNA和HilyMax量。如果转染效率较低,请适当提高HilyMax的量;
如果毒性过高,请适当降低HilyMax的使用量。

表2:表明了不同大小培养板的系数。这些系数是在24孔板下计算得出的,表1中DNA和HilyMax的数据可以乘上这些系数。

不同培养板转染状况:
表3:不同培养板适合的培养基、DNA的使用量以及DNA和HilyMax混合比率列。
NIH3T3, HEK293, CHO, HeLa及COS-7推荐转染条件:
NIH3T3, HEK293, CHO, HeLa及COS-7在24孔板培养的最适转染条件显示在表4中,每种细胞系DNA和HilyMax溶液最适量及其密度以及转染实验的基本操作。
若使用其他培养板请参考表3。
转染后培养基的更换:
转染后更换培养基可以有效地提高NIH3T3, HEK293, CHO, HeLa及COS-7的转染效率(请见表图)。
这五种细胞系转染后2到4小时更换培养基可以获得更高的转染率。
表4:五种细胞的实例

24孔板上转染发生于80%汇合细胞中, DNA和 HilyMax 分别为 1μg和3-7μl。转染1至8小时后,更换新的培养基
有详细操作方案的细胞种类:
(欢迎来电或邮箱索取各细胞系操作优化条件)
・A549 Cell ・HepG2 Cell ・MDCK Cell ・Caco2 Cell ・K562 Cell
・Neuro2a Cell ・Vero Cell ・CHO Cell ・L6 Cell ・NIH3T3 Cell
・HEK293 Cell ・LNCap Cell ・PC3 Cell ・HeLa Cell ・MCF7 Cell ・PC12 Cell
技术情报
使用HilyMax及I社产品转染率对比

使用HilyMax及R社产品Luciferase表达比较

★细胞系:用于HEK293、NIH3T3、CHO、HeLa、COS-7转染效果较好,具体请参考下列图表(实验案例)
★DNA:用于纯化质粒DNA(A280/A260=1.7-1.9)推荐转染的DNA浓度为0.15-1.0 mg/ml。转染中DNA的最佳使用量取决于细胞的类型及细胞密度。
★HilyMax:转染时HilyMax的最佳使用量取决于细胞的类型及细胞密度。若HilyMax使用量过低会致使转染效率低,而使用量过高则会产生较强的毒性,请在第一次实验时把DNA(μg)与HilyMax的使用比率控制在1:1-1:6之间。
★细胞密度:推荐的转染细胞密度为40%-90%的汇合细胞,最佳细胞密度取决于细胞类型。
★转染后培养基的更换:在转染后更换培养基可以提高转染效率,还可降低一些细胞系的毒性。推荐转染2到4小时后更换培养基
HilyMax的使用准备:
添加1.0 ml Lipoform缓冲液于HilyMax试剂中,使用涡旋器振荡混合30秒。请检查HilyMax试剂是否完全溶解,如果溶液中仍有部分不溶残留物,需继续振荡或使用移液器充分混匀,直到完全溶解。
提醒:转染效率与细胞种类、细胞浓度以及DNA与HilyMax的混合比例等情况有关,请参照以下优化条件操作。
储存注意事项:
试剂盒保存在0-5℃
添加过Lipoform缓冲液的HilyMax溶液在-20℃下可以储存6个月。
若经常使用, HilyMax溶液可放置于在0-5℃下, 请在1-2个月内用完。
解冻开启过的HilyMax溶液,需使用涡旋器和移液器使其充分混匀。
HilyMax溶液在反复冷冻和解冻后会有小部分出现不溶,但这并不会影响转染效果。
参考文献
1. Mammalian polymerase h promotes alternativeNHEJ and suppresses recombination, Nature, 2015, 518, 254-257
2. A combinatorial F box protein directed pathway controls TRAF adaptor stability to regulate inflammation,Nature Immunology, 2013, 14, 470-479
3. F-box protein FBXL2 targets cyclin D2 for ubiquitination and degradation to inhibit leukemic cell proliferation,Blood, 2012, 119(13), 3132-3141
4. Dual Roles of Notch in Regulation of Apically Restricted Mitosis and Apicobasal Polarity of Neuroepithelial Cells,Neuron, 2011, 69, 215-230
5. Facile target validation in an animal model with intracellularly expressed monobodies,Nature Chemical Biology, 2018, 14, 895-900
6. Living functional hydrogels generated by bioorthogonal cross-linking reactions of azidemodified cells with alkyne-modified polymers, Nature Communications, 2018, 9, 2195
7. Structural insights into the competitive inhibition of the ATP-gated P2X receptor channel,Nature Communications, 2017, 8(1), 876
8. Critical roles of nardilysin in the maintenance of body temperature homoeostasis,
Nature Communications, 2014, 5, 3224
9. Relative motions between left flipper and dorsal fin domains favour P2X4 receptor activation,Nature Communications, 2014, 5, 4189
10. Rhythmic binding of Topoisomerase I impacts on the transcription of Bmal1 and circadian period,Nucleic Acids Research, 2012, 40(19), 9482-9492
11. MEF/ELF4 transactivation by E2F1 is inhibited by p53, Nucleic Acids Research, 2011, 39(1), 76-88
12. CD52 as a molecular target for immunotherapy to treat acute myeloid leukemia with high EVI1 expression,Leukemia, 2011, 25, 921-931
13. Druggable negative allosteric site of P2X3 receptors, Proc. Natl. Acad. Sci., 2018, 115(19), 4939-4944
14. PARP-1-dependent recruitment of cold-inducible RNA-binding protein promotes double-strand break repair and
genome stability, Proc. Natl. Acad. Sci., 2018, 115(8), E1759-E1768
15. Enhancement of β-catenin activity by BIG1 plus BIG2 via Arf activation and cAMP signals,
Proc. Natl. Acad. Sci., 2016, 113(21), 5946-51
16. Transcriptome analysis of distinct mouse strains reveals kinesin light chain-1 splicing as an amyloid-β accumulation
modifier, Proc. Natl. Acad. Sci., 2014, 111(7), 2638-43
17. Arf guanine nucleotide-exchange factors BIG1 and BIG2 regulate nonmuscle myosin IIA activity by anchoring myosin
phosphatase complex, Proc. Natl. Acad. Sci., 2013, 110(34), E3162-70
18. EDEM Function in ERAD Protects against Chronic ER Proteinopathy and Age-Related Physiological Decline in
Drosophila, Developmental Cell, 2017, 41, 652-664
19. MicroRNA-200a promotes anoikis resistance and metastasis by targeting YAP1 in human breast cancer,
Clinical Cancer Research, 2013, 19(6), 1389-99
20. Long noncoding RNA ELIT-1 acts as a Smad3 cofactor to facilitate TGF-β/Smad signaling and promote
epithelial-mesenchymal transition, Cancer Research, 2019, 79(11), 2821-2838
21. Loss of NDRG2 Expression Confers Oral Squamous Cell Carcinoma with Enhanced Metastatic Potential,
Cancer Research, 2017, 77(9), 2363-2374
常见问题Q&A
| Q1、基因转染后需要更换培养基吗? |
| A1、如果您想让细胞毒性更低或者转染效率更高一些,建议更换培养基。但是有些细胞(如CHO细胞)案例,更换培养基不会影响毒性和转染率。 |
| Q2、转染效果不好的情况下,应当考虑调整哪些方面?(DNA量,HilyMax量,复合物形成比,时间等) |
| A2、<细胞毒性低>
转染效率极低的情况下,可以增加DNA量,或是DNA(μg):HilyMax(μL)=1:5~1:9。 可以提高转染效率。 <细胞毒性高> 可以减少DNA量或HilyMax量。 |
| Q3、说明书中写了保存条件为“冷藏”和“冷冻”两种。怎么保存比较好呢?一开始就冷冻,一直冷藏是不行的吗? |
| A3、未开封、未使用时请“冷藏保存”,试药和缓冲液混合溶解后请“冷冻保存”。即使在未开封的状态下冷冻保存,质量也没有问题,但是使用时需要将冷冻的Lipoform Buffer融化。
另外,溶解后如果在2~3周内用完的话,即使“冷藏保存”也不会影响性能。超过数周使用时,请务必“冷冻保存”。 |
| Q4、DNA-Hilymax 转染复合物培养是否超过30分钟? |
| A4、超过30分钟的培养会造成过低的转染率。 |
| Q5、DNA和Hilymax的量是否为最优比率? |
| A5、 DNA和Hilymax的量的比率会较大影响转染效率,请参考表1优化转染。某些条件下,增大DNA或HIlymax的使用量会提高转染效率,如果转染效率仍很低,那么优化后请改变DNA(ug):Hilymax(ul)比率至1:7-1:9或把DNA量提高到1.5-2倍。若毒性过强,请降低Hilymax在DNA-Hilymax转染复合物中的比率。 |

细胞内有各种各样的细胞器,承担着各种各样必须的生命活动。其中线粒体不仅是通过氧化磷酸化反应生成ATP的场所,它还与癌症、细胞衰老、阿尔兹海默症、帕金森综合症等神经退行性疾病紧密相关,因此它是细胞内最重要的细胞器之一。
在对线粒体的形态和动态进行观察以及定量检测时,通常使用小分子荧光探针标记和荧光蛋白的基因转染两种方法。荧光蛋白的基因转染存在转染效率不稳定等情况,因此操作简便的小分子荧光探针的使用更为广泛。现在市面上销售的小分子荧光探针中,多为含有氯甲基的探针,该探针存在观察时间短,染色时不能使用含血清的培养基,染色后荧光背景高等问题。MitoBright LT荧光探针克服了这些问题,可在线粒体内稳定存在一天以上,条件合适的情况下可达到一周。而且与含有氯甲基的探针相比,染色后的荧光强度更高。本品直接采用DMSO溶液包装,可快速方便的进行线粒体染色。荧光颜色有Green, Red, Deep Red等多种选择,可满足多重染色等各种各样的实验要求。
产品特点
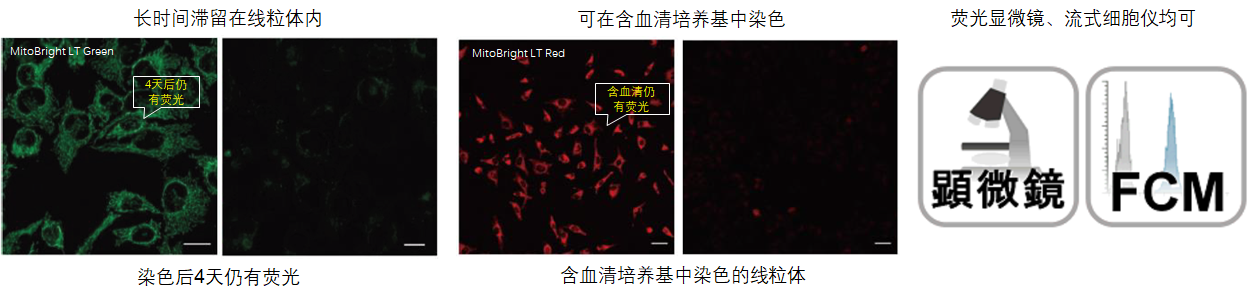
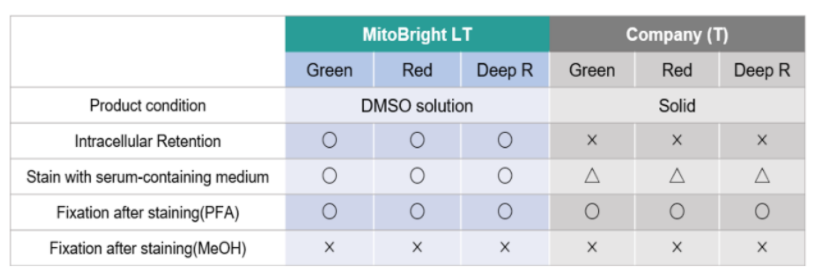
1.可长时间在细胞内存在
用HBSS清洗HeLa细胞后,分别用MitoBright LT和其他公司的试剂进行染色,更换含血清的培养基,培养4天后观察线粒体染色情况。其他公司的染色试剂在4天后荧光强度大幅降低,而MitoBright LT依然维持着高荧光强度,并且在染色7日后依然可以观察到荧光。
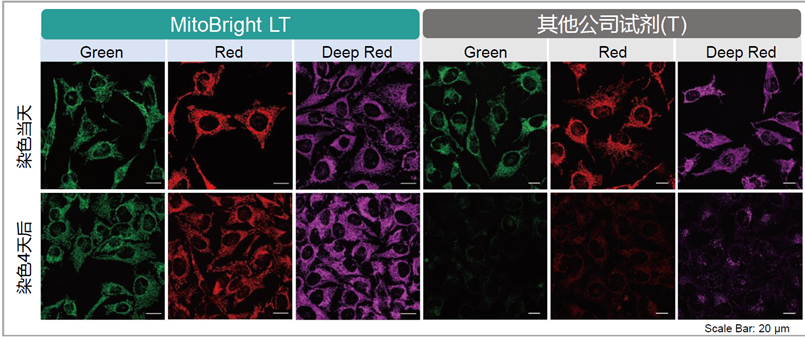
<检测条件>
MitoBright LT Green 、(T公司)Green:Ex 488 nm/Em 500–560 nm
MitoBright LT Red 、(T公司)Red:Ex 561 nm/Em 560–620 nm
MitoBright LT Deep Red 、(T公司)Deep Red:Ex 640 nm/Em 650–700 nm
2.可以使用含血清培养基
用MitoBright LT和其他公司试剂,分别用含有血清和不含血清的培养基染色。其他公司试剂在含有血清的培养基染色时,荧光明显减弱,而MitoBright LT在含有血清的培养基条件下,荧光没有减弱,可明显观察到线粒体的染色情况。

实验例
实时荧光观察
HeLa细胞用CCCP处理,并与线粒体检测试剂(Mtphagy Dye)和线粒体染色试剂(MitoBright LT Green)共同染色,并经过一段时间(6小时)后进行检测。
<检测条件>
设备:LSM-700 Laser scanning confocal microscope (LSCM)
(Carl Zeiss, Oberkochen, Germany)
激发波长:
MitoBright LT Green 488 nm
Mtphagy Dye 555 nm
物镜:63x
拍摄时间:6小时
拍摄间隔:15秒
用流式细胞仪检测
1. 用RPMI培养基(10% Fetal Bovine Serum, 1% Penicillin-Streptomycin)配制Jurkat细胞悬液(3.2×105cell/ml)接种于5 cm培养皿中,在37℃,5% CO2培养箱内过夜培养。
2. 去除培养基,加入MitoBright LT Working Solution (0.1 μmol/l, 5 ml), 在37℃培养30分钟。
3. 去除溶液,用 5 ml的PRPMI培养基清洗细胞2 次。
4. 更换RPMI培养基,持续培养细胞,每隔2 天用流式细胞仪检测。
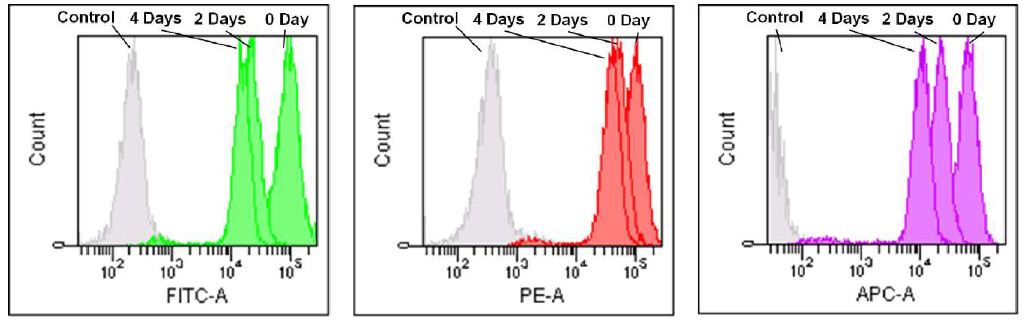
MitoBright LT Green MitoBright LT Red MitoBright LT Deep Red
Excitation: 488 nm Excitation: 488 nm Excitation: 633 nm
Emission: 515-545 nm Emission: 564-604 nm Emission: 650-670 nm
在胶原蛋白涂覆玻璃板上观察线粒体荧光成像
胶原蛋白涂覆玻璃板通常用于线粒体形态的高倍放大观察。
现有的线粒体染色试剂存在吸附胶原蛋白和升高背景的问题,但是MitoBright LT系列可以在不受背景影响的情况下清楚地对线粒体进行染色。
<染色条件>
将HeLa细胞接种在胶原蛋白涂覆玻璃板上,培养24小时,提取上清液并用HBSS洗涤。
加入100 nmol/l的MitoBright LT Green工作溶液,培养30分钟后,提取上清液并用HBSS洗涤后用荧光显微镜观察。
<检测条件>
Ex 488 nm,Em 500-560 nm
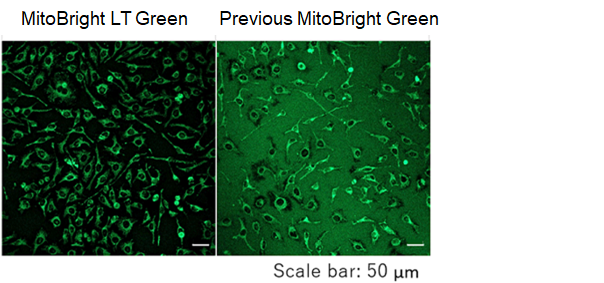
<结果>
现有的线粒体染色剂存在吸附胶原蛋白和升高背景的问题,但是MitoBright LT系列可以清晰地对线粒体染色,而不受背景影响。
通过超分辨率激光显微镜(STED)观察线粒体内部构造
线粒体疾病致突变的Cybrid细胞用MitoBright-LT-Deep Red染色,用超分辨激光显微镜(STED)观察,证实线粒体嵴结构异常。

<实验条件>
色素:MitoBrightLT Deep Red(100 nmol/l)
仪器:Leica超分辨率激光显微镜TCS SP8 STED 3X
Ex. 640 nm / Em. 650-700 nm
STED激光:775nm
<实验步骤>
1将细胞接种在玻璃培养皿中,培养2天(37℃,5% CO2)。
2去除培养基后,加入使用L-15培养基(含10%FBS)制备的MitoBrightLT Deep Red(100 nmol/l)工作液。
3孵育45分钟(37度,5% CO2)。
4去除上清液,用HBSS清洗两次。
5加入L-15培养基(含10%FBS),通过超分辨率激光显微镜(Leica TCS SP8 STED)进行观察。
以上数据由东京都老年学研究所衰老控制研究小组的大澤郁朗博士和藤田泰典博士友情提供。
产品文献
同仁化学研究所开发的线粒体长效染色荧光探针MitoBright LT系列在世界范围内广受科研人员的好评。在上市后的很短时间内,就出现了多篇使用MitoBright LT系列探针的论文,下面收集整理了部分的论文,其中红色字体标记的是使用本产品标记线粒体后,长时间(最长至5天)观察线粒体动态的报道,供感兴趣的科研人员参考。
| 产品名 | 检测样品 | 染色后的 观察时间 |
检测仪器 | 发表期刊(含原文链接) | 影响因子 |
| MitoBright LT Green | 细胞 (U251) | 立即 | 荧光显微镜 | Pharmaceuticals | 4.286 |
| MitoBright LT Green | 酵母 (Lipomyces starkeyi) | 立即 | 荧光显微镜 | Genes to Cells | 1.655 |
| MitoBright LT Green | 细胞 (HeLa) | 立即 | 荧光酶标仪 | Biomaterials | 10.317 |
| MitoBright LT Green | 细胞 (Naive CD4+ T cells) | 立即 | 荧光显微镜 | Cell Reports | 9.423 |
| MitoBright LT Green | 细胞 (CT26) | 立即 | 流式细胞仪 | Journal of Radiation Research | 2.841 |
| MitoBright LT Green | 细胞 (C2C12) | 5 天 | 荧光显微镜 | Polymers | 4.329 |
| MitoBright LT Green | 细胞 (BMM) | 36 小时 or
3 天 |
荧光显微镜/ 流式细胞仪 |
JCI Insights | 8.315 |
| MitoBright LT Green | 细胞 (mouse erythrocytes) | 立即 | 荧光显微镜 | Front. Cell. Infect. Microbiol. | 5.293 |
| MitoBright LT Red | 细胞 (SH-SY5Y) | 立即 | 荧光显微镜 | Free Radical Biol. Med. | 7.376 |
| MitoBright LT Red | 细胞 (MRC-5) | 立即 | 荧光显微镜 | The FEBS Journal | 5.542 |
| MitoBright LT Red | 细胞 (A11 cells/ P29 cells) | 3 天 | 荧光显微镜 | BMC Mol. Cell Biol. | 5.293 |
| MitoBright LT Deep Red | 细胞 (HT-1080; MCF-10A; MCF-7; HCT-116 ) | 立即 | 荧光显微镜 | Small | 13.281 |
| MitoBright LT Deep Red | 细胞 (HT-1080; MCF-10A; MCF-7 ) | 8 小时 | 荧光显微镜 | Advanced Therapeutics | – |
| MitoBright LT Deep Red | 细胞 (4T1) | 24 小时 | 荧光显微镜 | Advanced Functional Materials | 18.808 |
| MitoBright LT Deep Red | 细胞 (SW982) | 立即 | 荧光显微镜 | Gene | 3.368 |
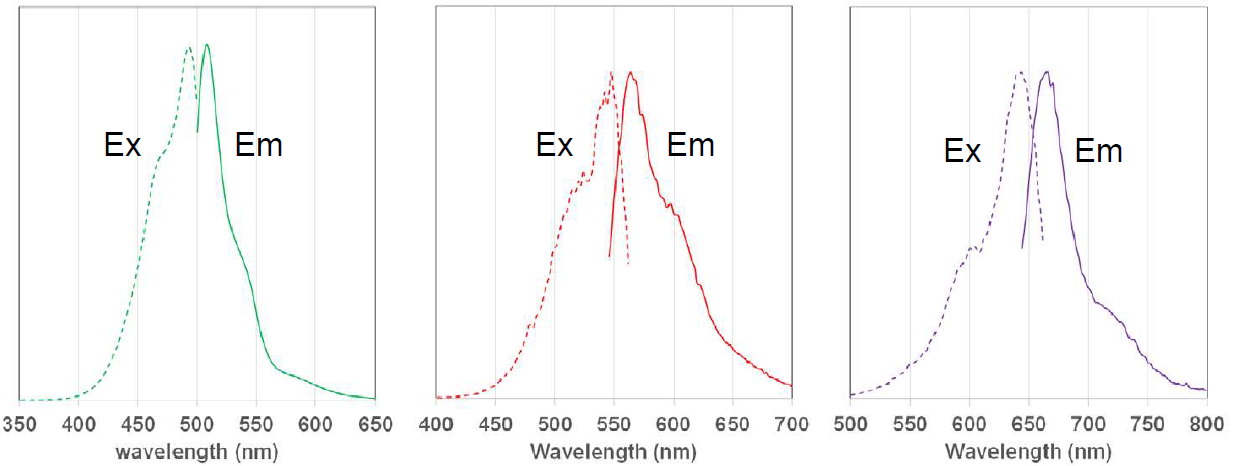
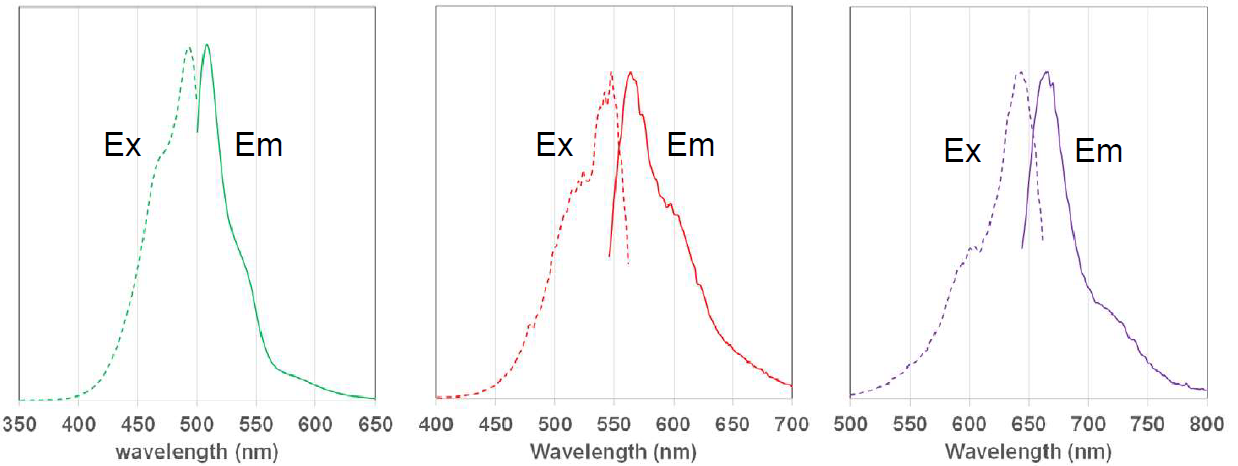
荧光特性
MitoBright LT 染料的荧光特性
常见问题Q&A
| Q1:MitoBright LT需要用DMSO溶液配制,反复冻结融化也不会影响试剂质量吗? |
| A1:我们已经确认可以使用冻融30次的溶液进行染色。 |
| Q2:MitoBright LT和MitoBright的区别。 |
| A2:MitoBright LT是MitoBright具有更强细胞内滞留性性能的产品。另外MitoBright LT是溶于DMSO的产品,可以立即使用,而无需准备染色溶液。 |
|
Q3:用MitoBright LT系列染色后再去极化是否会影响染色效果? |
| A3:我们确认了去极化和细胞种类对于染色效果的影响,MitoBright LT的每种染料都有不同程度的影响。作为参考,本公司将HeLa细胞用不同的MitoBrightLT试剂进行染色,在以下条件下进行去极化处理,观察荧光染色的变化。
<染色条件> HeLa细胞用MitoBright LT(100 μmol/l,孵育30分钟)染色,并用HBSS洗涤。 用FCCP(100 μmol/l,孵育60分钟)处理,用HBSS洗涤2次,然后观察荧光。
<检测条件> MitoBright LT Green :Ex 488 nm/Em 500–560 nm MitoBright LT Red :Ex 561 nm/Em 560–620 nm MitoBright LT Deep Red :Ex 640 nm/Em 650–700 nm |
规格性状
性状:本品是黄色液体
吸光度:0.600~0.800(490 nm附近)

产品概述
细胞内有各种各样的细胞器,承担着各种各样必须的生命活动。其中线粒体不仅是通过氧化磷酸化反应生成ATP的场所,它还与癌症、细胞衰老、阿尔兹海默症、帕金森综合症等神经退行性疾病紧密相关,因此它是细胞内最重要的细胞器之一。
在对线粒体的形态和动态进行观察以及定量检测时,通常使用小分子荧光探针标记和荧光蛋白的基因转染两种方法。荧光蛋白的基因转染存在转染效率不稳定等情况,因此操作简便的小分子荧光探针的使用更为广泛。现在市面上销售的小分子荧光探针中,多为含有氯甲基的探针,该探针存在观察时间短,染色时不能使用含血清的培养基,染色后荧光背景高等问题。MitoBright LT荧光探针克服了这些问题,可在线粒体内稳定存在一天以上,条件合适的情况下可达到一周。而且与含有氯甲基的探针相比,染色后的荧光强度更高。本品直接采用DMSO溶液包装,可快速方便的进行线粒体染色。荧光颜色有Green, Red, Deep Red等多种选择,可满足多重染色等各种各样的实验要求。
产品特点
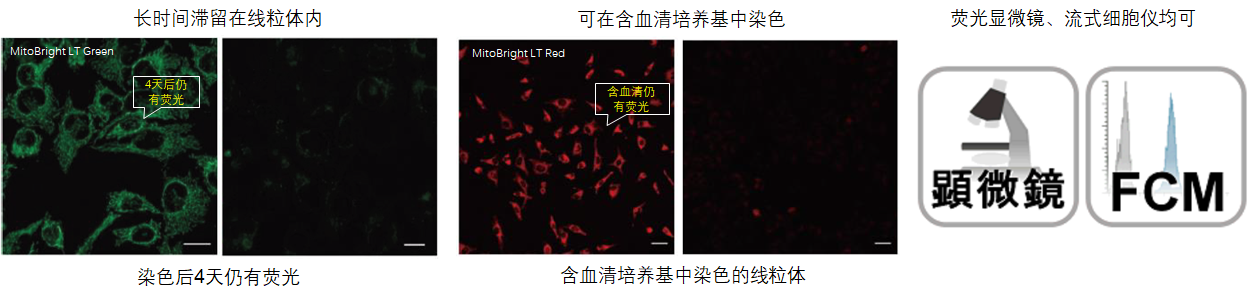
1.可长时间在细胞内存在
用HBSS清洗HeLa细胞后,分别用MitoBright LT和其他公司的试剂进行染色,更换含血清的培养基,培养4天后观察线粒体染色情况。其他公司的染色试剂在4天后荧光强度大幅降低,而MitoBright LT依然维持着高荧光强度,并且在染色7日后依然可以观察到荧光。
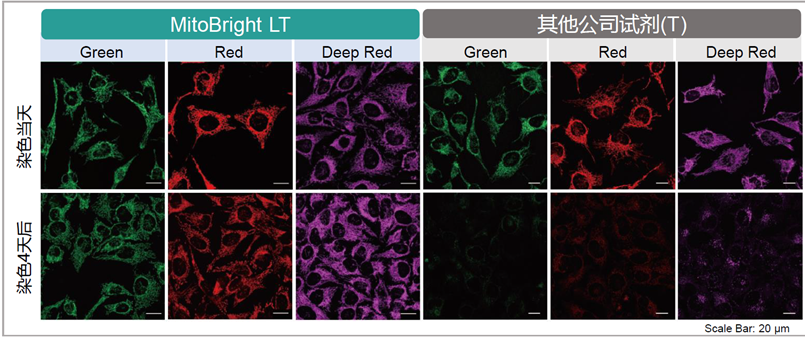
<检测条件>
MitoBright LT Green 、(T公司)Green:Ex 488 nm/Em 500–560 nm
MitoBright LT Red 、(T公司)Red:Ex 561 nm/Em 560–620 nm
MitoBright LT Deep Red 、(T公司)Deep Red:Ex 640 nm/Em 650–700 nm
2.可以使用含血清培养基
用MitoBright LT和其他公司试剂,分别用含有血清和不含血清的培养基染色。其他公司试剂在含有血清的培养基染色时,荧光明显减弱,而MitoBright LT在含有血清的培养基条件下,荧光没有减弱,可明显观察到线粒体的染色情况。

实验例
实时荧光观察
HeLa细胞用CCCP处理,并与线粒体检测试剂(Mtphagy Dye)和线粒体染色试剂(MitoBright LT Green)共同染色,并经过一段时间(6小时)后进行检测。
<检测条件>
设备:LSM-700 Laser scanning confocal microscope (LSCM)
(Carl Zeiss, Oberkochen, Germany)
激发波长:
MitoBright LT Green 488 nm
Mtphagy Dye 555 nm
物镜:63x
拍摄时间:6小时
拍摄间隔:15秒
用流式细胞仪检测
1. 用RPMI培养基(10% Fetal Bovine Serum, 1% Penicillin-Streptomycin)配制Jurkat细胞悬液(3.2×105cell/ml)接种于5 cm培养皿中,在37℃,5% CO2培养箱内过夜培养。
2. 去除培养基,加入MitoBright LT Working Solution (0.1 μmol/l, 5 ml), 在37℃培养30分钟。
3. 去除溶液,用 5 ml的PRPMI培养基清洗细胞2 次。
4. 更换RPMI培养基,持续培养细胞,每隔2 天用流式细胞仪检测。
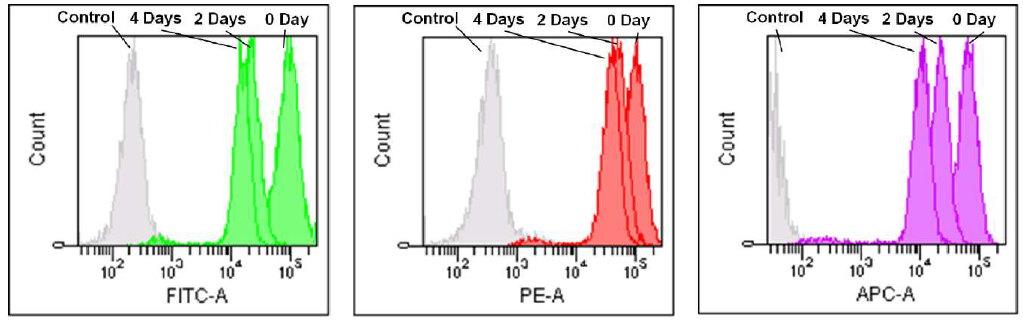
MitoBright LT Green MitoBright LT Red MitoBright LT Deep Red
Excitation: 488 nm Excitation: 488 nm Excitation: 633 nm
Emission: 515-545 nm Emission: 564-604 nm Emission: 650-670 nm
在胶原蛋白涂覆玻璃板上观察线粒体荧光成像
胶原蛋白涂覆玻璃板通常用于线粒体形态的高倍放大观察。
现有的线粒体染色试剂存在吸附胶原蛋白和升高背景的问题,但是MitoBright LT系列可以在不受背景影响的情况下清楚地对线粒体进行染色。
<染色条件>
将HeLa细胞接种在胶原蛋白涂覆玻璃板上,培养24小时,提取上清液并用HBSS洗涤。
加入100 nmol/l的MitoBright LT Green工作溶液,培养30分钟后,提取上清液并用HBSS洗涤后用荧光显微镜观察。
<检测条件>
Ex 488 nm,Em 500-560 nm
<结果>
现有的线粒体染色剂存在吸附胶原蛋白和升高背景的问题,但是MitoBright LT系列可以清晰地对线粒体染色,而不受背景影响。
通过超分辨率激光显微镜(STED)观察线粒体内部构造
线粒体疾病致突变的Cybrid细胞用MitoBright-LT-Deep Red染色,用超分辨激光显微镜(STED)观察,证实线粒体嵴结构异常。

<实验条件>
色素:MitoBrightLT Deep Red(100 nmol/l)
仪器:Leica超分辨率激光显微镜TCS SP8 STED 3X
Ex. 640 nm / Em. 650-700 nm
STED激光:775nm
<实验步骤>
1将细胞接种在玻璃培养皿中,培养2天(37℃,5% CO2)。
2去除培养基后,加入使用L-15培养基(含10%FBS)制备的MitoBrightLT Deep Red(100 nmol/l)工作液。
3孵育45分钟(37度,5% CO2)。
4去除上清液,用HBSS清洗两次。
5加入L-15培养基(含10%FBS),通过超分辨率激光显微镜(Leica TCS SP8 STED)进行观察。
以上数据由东京都老年学研究所衰老控制研究小组的大澤郁朗博士和藤田泰典博士友情提供。
产品文献
同仁化学研究所开发的线粒体长效染色荧光探针MitoBright LT系列在世界范围内广受科研人员的好评。在上市后的很短时间内,就出现了多篇使用MitoBright LT系列探针的论文,下面收集整理了部分的论文,其中红色字体标记的是使用本产品标记线粒体后,长时间(最长至5天)观察线粒体动态的报道,供感兴趣的科研人员参考。
| 产品名 | 检测样品 | 染色后的 观察时间 |
检测仪器 | 发表期刊(含原文链接) | 影响因子 |
| MitoBright LT Green | 细胞 (U251) | 立即 | 荧光显微镜 | Pharmaceuticals | 4.286 |
| MitoBright LT Green | 酵母 (Lipomyces starkeyi) | 立即 | 荧光显微镜 | Genes to Cells | 1.655 |
| MitoBright LT Green | 细胞 (HeLa) | 立即 | 荧光酶标仪 | Biomaterials | 10.317 |
| MitoBright LT Green | 细胞 (Naive CD4+ T cells) | 立即 | 荧光显微镜 | Cell Reports | 9.423 |
| MitoBright LT Green | 细胞 (CT26) | 立即 | 流式细胞仪 | Journal of Radiation Research | 2.841 |
| MitoBright LT Green | 细胞 (C2C12) | 5 天 | 荧光显微镜 | Polymers | 4.329 |
| MitoBright LT Green | 细胞 (BMM) | 36 小时 or
3 天 |
荧光显微镜/ 流式细胞仪 |
JCI Insights | 8.315 |
| MitoBright LT Green | 细胞 (mouse erythrocytes) | 立即 | 荧光显微镜 | Front. Cell. Infect. Microbiol. | 5.293 |
| MitoBright LT Red | 细胞 (SH-SY5Y) | 立即 | 荧光显微镜 | Free Radical Biol. Med. | 7.376 |
| MitoBright LT Red | 细胞 (MRC-5) | 立即 | 荧光显微镜 | The FEBS Journal | 5.542 |
| MitoBright LT Red | 细胞 (A11 cells/ P29 cells) | 3 天 | 荧光显微镜 | BMC Mol. Cell Biol. | 5.293 |
| MitoBright LT Deep Red | 细胞 (HT-1080; MCF-10A; MCF-7; HCT-116 ) | 立即 | 荧光显微镜 | Small | 13.281 |
| MitoBright LT Deep Red | 细胞 (HT-1080; MCF-10A; MCF-7 ) | 8 小时 | 荧光显微镜 | Advanced Therapeutics | – |
| MitoBright LT Deep Red | 细胞 (4T1) | 24 小时 | 荧光显微镜 | Advanced Functional Materials | 18.808 |
| MitoBright LT Deep Red | 细胞 (SW982) | 立即 | 荧光显微镜 | Gene | 3.368 |
荧光特性
MitoBright LT 染料的荧光特性
常见问题Q&A
| Q1:MitoBright LT需要用DMSO溶液配制,反复冻结融化也不会影响试剂质量吗? |
| A1:我们已经确认可以使用冻融30次的溶液进行染色。 |
| Q2:MitoBright LT和MitoBright的区别。 |
| A2:MitoBright LT是MitoBright具有更强细胞内滞留性性能的产品。另外MitoBright LT是溶于DMSO的产品,可以立即使用,而无需准备染色溶液。 |
|
Q3:用MitoBright LT系列染色后再去极化是否会影响染色效果? |
| A3:我们确认了去极化和细胞种类对于染色效果的影响,MitoBright LT的每种染料都有不同程度的影响。作为参考,本公司将HeLa细胞用不同的MitoBrightLT试剂进行染色,在以下条件下进行去极化处理,观察荧光染色的变化。
<染色条件> HeLa细胞用MitoBright LT(100 μmol/l,孵育30分钟)染色,并用HBSS洗涤。 用FCCP(100 μmol/l,孵育60分钟)处理,用HBSS洗涤2次,然后观察荧光。
<检测条件> MitoBright LT Green :Ex 488 nm/Em 500–560 nm MitoBright LT Red :Ex 561 nm/Em 560–620 nm MitoBright LT Deep Red :Ex 640 nm/Em 650–700 nm |
规格性状
性状:本品是黄色液体
吸光度:0.600~0.800(490 nm附近)