特点:
● 灵敏度高
● 易上手
● 多种仪器均可检测

凑单关联产品TOP5
NO.1. Cell Counting Kit-8 细胞增殖毒性检测
NO.2. ROS Assay Kit 活性氧检测
NO.3. FerroOrange 细胞亚铁离子检测
NO.4. GSSG/GSH Quantification Kit II 氧化型/还原型谷胱甘肽
NO.5. Mitophagy Detection Kit 线粒体自噬检测
试剂盒内含

产品概述
细胞中的线粒体作为有氧呼吸产生ATP的主要场所,是体内重要的细胞器之一,常被用于早期细胞毒性、氧化应激、细胞凋亡等研究中1)。线粒体活性的降低与机能失调,已被证实与癌症、衰老、神经退行性疾病 (如阿尔兹海默症、帕金森病等) 等密切相关2)3)。
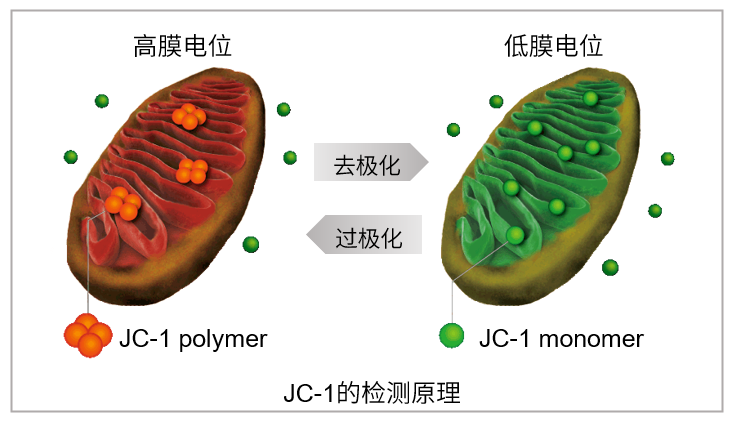
JC-1是一种被广泛使用的小分子线粒体膜电位探针,依赖于线粒体膜电位在线粒体中聚集,染料伴随聚集过程,荧光从绿色 (530 nm) 变为红色 (590 nm)。当线粒体发生去极化,红/绿荧光强度比值降低。以往的研究者反映,JC-1不易溶于水并有大量沉淀产生。但与其他公司的产品不同,同仁化学研究所研制的JC-1试剂解决了这一问题,避免了沉淀的产生。同时使用试剂盒中配制的成像缓冲液 (Imaging Buffer),可大幅降低荧光背景并在检测过程中保护细胞不受损伤。
当JC-1工作液的浓度为2 μmol/l, 每次用量为100 μl时,可以检测500次。
产品特点
1.为什么要检测线粒体膜电位
线粒体不仅是细胞内产生能量的场所,它还与癌症、衰老、阿尔兹海默症、帕金森等神经变异性疾病密切相关。因此,针对线粒体状态的研究非常重要,其中线粒体膜电位的变化经常被作为重要的指标之一检测。
当线粒体正常、膜电位差保持不变时,JC-1会聚集并发出红色荧光,而当膜电位降低时,JC-1会作为单体存在并发出绿色荧光。红色和绿色荧光强度的变化可以作为检测线粒体状态的指标。
2.初次使用也很容易上手

3.去极化的检测实例
使用去极化剂carbonylcyanide-p-trifluoromethoxyphenylhydrazone(FCCP)对HeLa细胞进行处理,用本试
剂盒进行检测。可以发现与未加药物的细胞相比,加药组细胞的红色荧光明显减少。
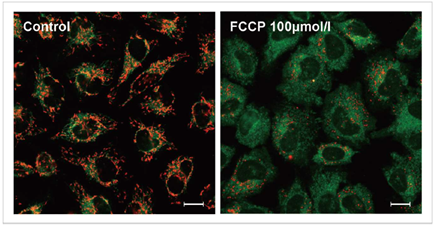
实验条件
JC-1浓度: 2 μmol/l in MEM, 染色时间30 min
FCCP浓度:100 μmol/l, FCCP处理时间1 h
检测条件
Green : Ex 488 nm/ Em 500-550 nm;
Red : Ex 561 nm/ Em 560-610 nm;
标尺: 20 μm
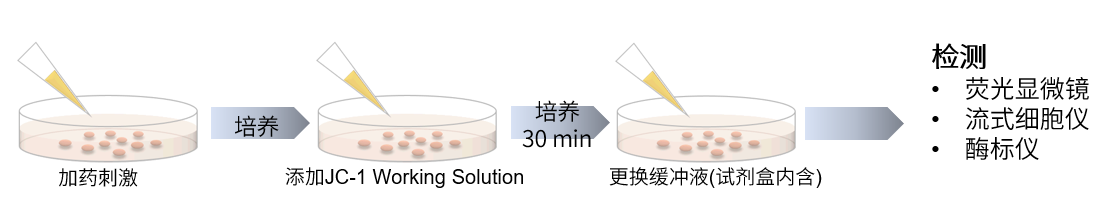
操作步骤
实验例
1.诱导凋亡的实验例
1.1 荧光显微镜
通过荧光颜色的改变判断由凋亡导致的线粒体膜电位的变化。
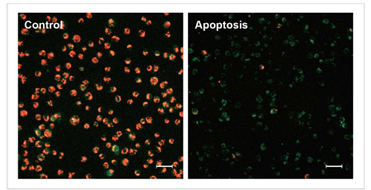
检测条件
Green: Ex 488 nm / Em 500-550 nm
Red : Ex 561 nm / Em 560-610 nm
标尺: 80 μm
1.2 流式细胞仪
定量分析单个细胞的膜电位变化
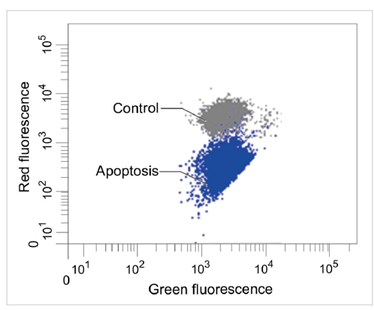
检测条件
Green: Ex 488 nm / Em 515-545 nm
Red : Ex 488 nm / Em 564-604 nm
1.3 酶标仪
确认孔板中吸光度来判断线粒体膜电位的变化
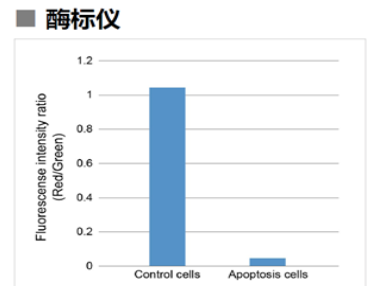
检测条件
Green: Ex 485 nm / Em 525-545 nm
Red : Ex 535 nm / Em 585-605 nm
2.诱导自噬的实验例
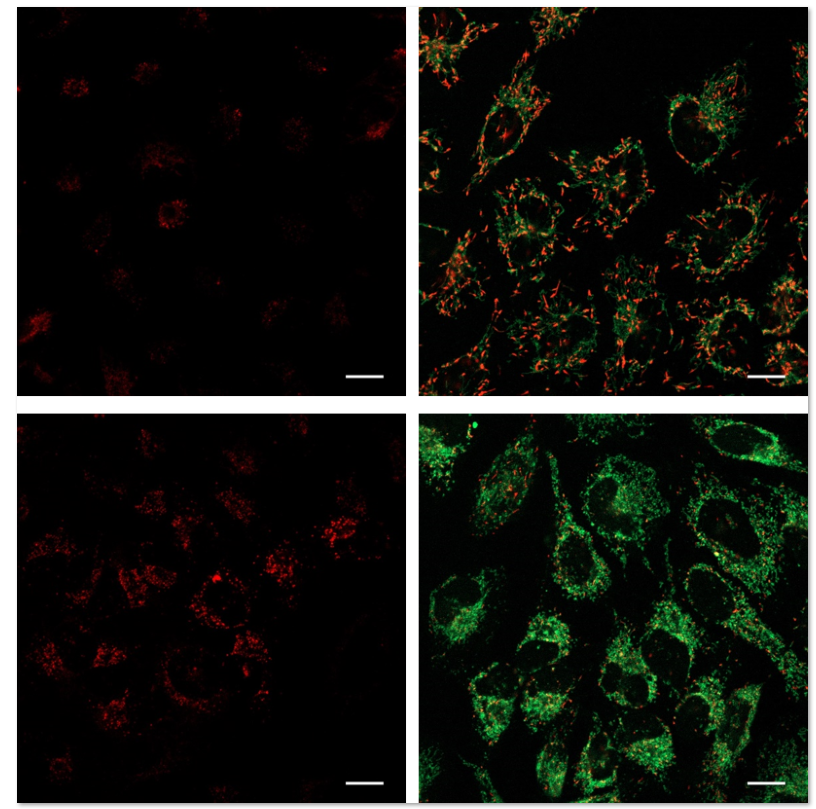
使用表达Parkin的HeLa细胞,分别使用线粒体自噬试剂盒(Mitophagy Detection Kit:MD01)和线粒体膜电位检测试剂盒(JC-1 MitoMP Detection Kit: MT09)来观察添加和不添加CCCP(羰基氰化物间氯苯)的线粒体状态的变化。
结果证明在未经CCCP处理的细胞中几乎未检测到线粒体自噬的发生,并且线粒体膜电位正常维持。 而在添加了CCCP的细胞中,证实了线粒体膜电位的降低(JC-1的红色荧光的降低)和线粒体的自噬(Mtphagy染料的荧光的增强)。
<检测条件>
线粒体自噬检测
Ex:561 nm,Em:570-700 nm
线粒体膜电位检测
绿色Ex:488 nm,Em:500-550 nm
红色Ex:561 nm,Em:560-610 nm
实验条件
1.将Parkin质粒导入HeLa细胞
使用HilyMax(货号:H357)将Parkin质粒引入HeLa细胞中(Parkin质粒/HilyMax试剂:0.1 μg/0.2 μl)
然后过夜培养,收集细胞进行以下检测。
2.自噬检测
向表达Parkin的HeLa细胞中添加0.1 μmol/l Mtphagy工作溶液,并在37°C下孵育30分钟。然后将细胞用HBSS洗涤,加入10 μg/ml CCCP/MEM溶液,并在37℃下孵育2小时。荧光显微镜下观察处理后的细胞。
3.线粒体膜电位检测
将10 μg/ml的CCCP/MEM溶液添加至表达Parkin的HeLa细胞中,并在37℃下孵育1.5小时。加入4 μmol/l的JC-1工作溶液使终浓度至2 μmol/l,并将细胞溶液在37℃下孵育30分钟。孵育后将细胞用HBSS洗涤,加入成像缓冲液,在荧光显微镜下观察细胞。
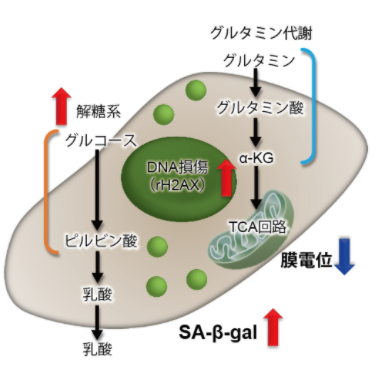
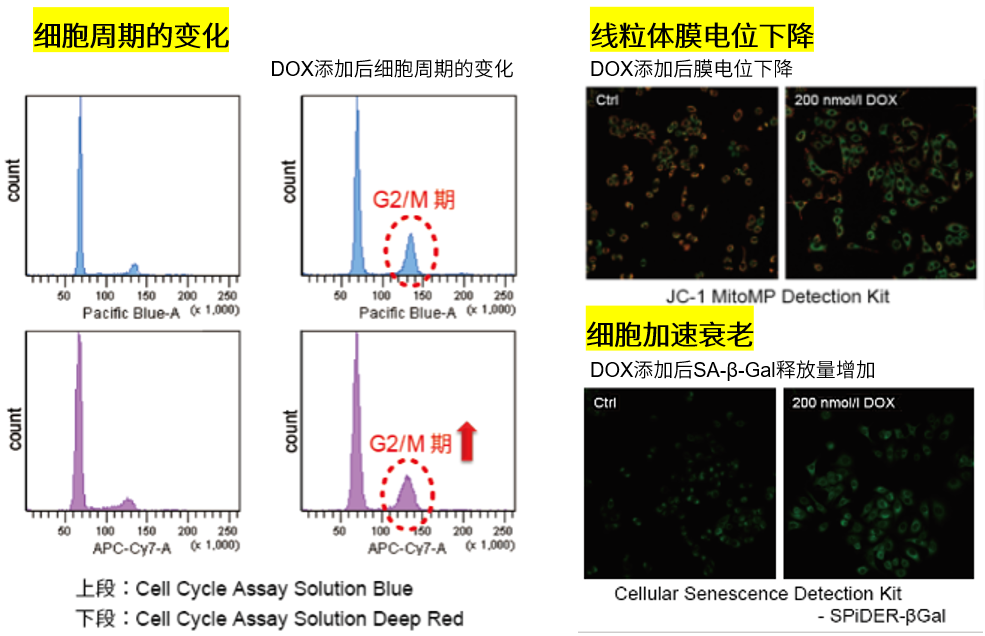
3.线粒体膜电位与细胞周期关联性
将已知能在细胞周期的G2/M期起作用以终止细胞增殖并诱导细胞衰老的阿霉素(DOX)加入A549细胞后,
使用细胞周期检测试剂盒蓝色(产品代码:C549)/深红色(产品代码:C548)后检测。
结果证实了A549细胞的细胞周期确实发生了变化,同时用细胞衰老检测试剂盒–SPiDER-βGal(产品代码:SG03)证实了细胞产生衰老,实验证实了线粒体膜电位会发生变化。
参考文献
| 文献No. | 检测对象 | 检测仪器 | 引用 |
| 1) | 细胞(U2OS, HeLa) | 荧光显微镜 | T. Namba, “BAP31 regulates mitochondrial function via interaction with Tom40 within ER-mitochondria contact sites “, Sci Adv., 2019, 5, (6), 1386. |
| 2) | 细胞(Neuron) | 荧光显微镜 | I. Kawahata, L. Luc Bousset, R. Melki and K. Fukunaga , “Fatty Acid-Binding Protein 3 is Critical for α-Synuclein Uptake and MPP+-Induced Mitochondrial Dysfunction in Cultured Dopaminergic Neurons “, Int J Mol Sci., 2019, 20, 5358. |
| 3) | 细胞(3T3L1, C2C12) | 流式细胞仪 | M. Kurano, K. Tsukamoto, T. Shimizu, H. Kassai, K. Nakao, A. Aiba, M. Hara and Yatomi , “Protection Against Insulin Resistance by Apolipoprotein M/Sphingosine 1-Phosphate “, Diabetes, 2020, DOI: 10.2337/db19-0811. |
| 4) | 细胞 | 流式细胞仪 | T. Nechiporuk, S.E. Kurtz, O. Nikolova, T. Liu, C.L. Jones, A. D. Alessandro, R. C. Hill, A. Almeida, S. K. Joshi, M. Rosenberg, C. E. Tognon, A. V. Danilov, B. J. Druker, B. H. Chang, S. K McWeeney and J. W. Tyner , “The TP53 Apoptotic Network Is a Primary Mediator of Resistance to BCL2 Inhibition in AML Cells.”, Cancer Discov, 2019, 9, |
| 5) | 细胞 | 荧光显微镜 | G. Yang, M. Fan, J. Zhu, C. Ling, L. Wu, X. Zhang, M. Zhang, J. Li, Q. Yao, Z. Gu and X. Cai, “A multifunctional anti-inflammatory drug that can specifically target activated macrophages massively deplete intracellular H2O2 and produce large amounts CO for a highly efficient treatment of osreoarthritis” , Biomaterials, 2020, doi:10.1016/j.biomaterials.2020.120155. |
| 6) | 细胞(ARPE-19) | 荧光显微镜 | J. H. Quan, F. F. Gao, H. A. Ismail, J. M. Yuk, G. H. Cha, J. Q. Chu and Y. H. Lee, “Silver Nanoparticle-Induced Apoptosis in ARPE-19 Cells Is Inhibited by Toxoplasma gondii Pre-Infection Through Suppression of NOX4-Dependent ROS Generation”, Int J Nanomedicine , 2020, 15, 3695–3716. |
常见问题Q&A
| Q1: 本试剂盒可以检测多少次? |
| A1:大概的使用次数请参考下表: |
| 检测装置 | 容器 | 使用次数 | 液量 |
| 流式细胞仪 | – | 100次 | 0.5 ml/次 |
| 荧光显微镜 荧光酶标仪 |
35 mm dish | 25次 | 2 ml/孔 |
| 8孔Chamber Slide | 30次 | 200 μl/孔 | |
| 96孔板 | 5次 | 100 μl/孔 |
| Q2:在JC-1染色后,可以使用PBS代替HBSS洗涤吗? |
| A2:我们建议使用HBSS来减少对细胞的损伤。如果您手边没有HBSS的话,建议使用培养基洗净。 |
| Q3:可以使用含血清的培养基吗? |
| A3:在清洗细胞和Working Solution中可以使用含血清的培养基。在观察荧光时建议使用Imaging Buffer。如果一定要使用含血清的培养基的话,建议不要加酚红。 |
| Q4:染色后细胞固定或者固定后进行染色可以实现吗? |
| A4:细胞固定操作会使得线粒体去极化,所以染色前后均不能进行细胞固定。 |
|
Q5:处理后的样品与对照组相比较,红和绿两种荧光值都增加(或减少)了,结果该如何解释? |
| A5:请先比较实验组和对照组的荧光比值,两者相比,荧光比越低,线粒体膜电位越低。
用荧光之比进行结果分析的理由。 JC-1由于膜电位依存性地在细胞中积蓄,根据细胞的状态,每个细胞的JC-1的浓度有可能不同。 由于对照组和实验组处理样品的细胞状态不同,JC-1的累积浓度不同。) 另外,在线粒体膜电位较高的状态下,JC-1会聚集在一起,使荧光从绿色转移到红色。 该聚集体的量取决于膜电位的程度,因此可以用红/绿之比来比较样品之间的线粒体膜电位。 |

