货号:D675
DALGreen – 细胞自噬荧光探针
DALGreen – Autophagy Detection
储存条件:-20度保存,避光
运输条件:室温
特点:
操作流程简便
与LC3结果一致性高
可以动态观察细胞自噬
选择规格:20 nmol
关联产品TOP5
NO.1. DAPRed – Autophagy Detection 细胞自噬检测
NO.2. Cell Counting Kit-8 细胞增殖毒性检测
NO.3. Mitophagy Detection Kit 线粒体自噬检测
NO.4. ROS Assay Kit 活性氧检测
NO.5. Annexin V, FITC Apoptosis Detection Kit 细胞凋亡检测
产品概述
细胞自噬是细胞内损坏的蛋白质或细胞器降解和循环利用的过程。
DALGreen是一种可以进入细胞膜检测细胞自噬的小分子脂溶性荧光染料,具有在酸性环境中产生荧光的特性,可以检测到自噬体与溶酶体融合形成的自噬溶酶体。
原理
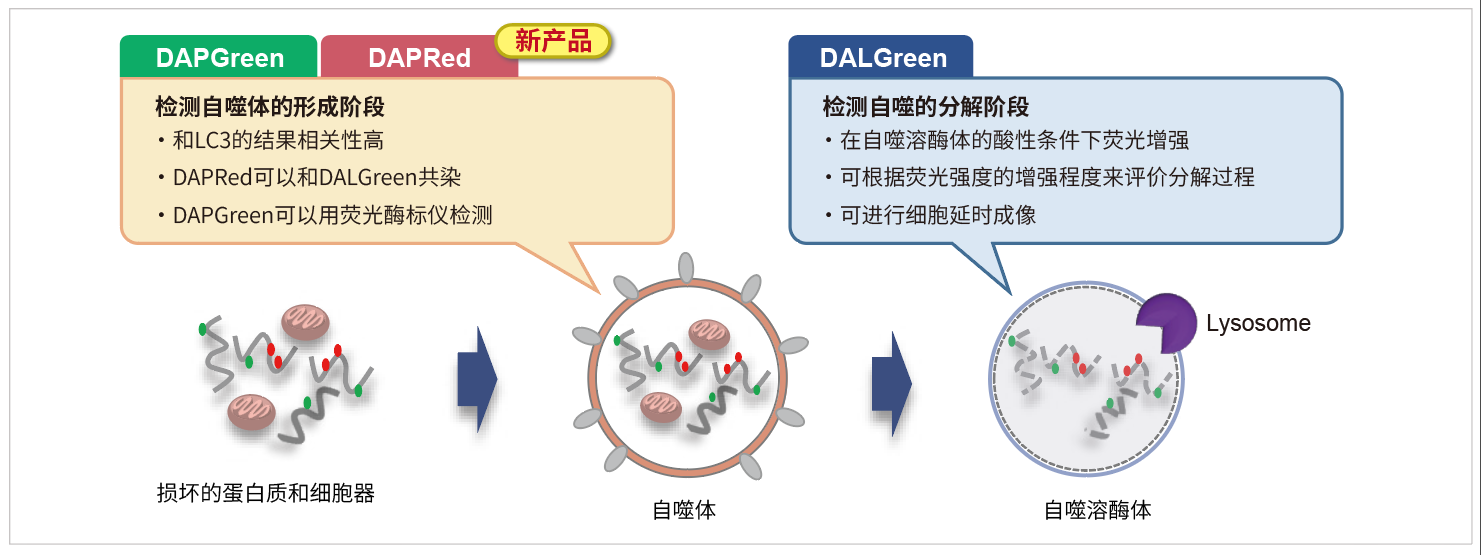

与DAPGreen和DAPRed一样,在自噬体形成的时候染料掺入细胞膜。然后当自噬体与溶酶体融合产生酸性环境时,DALGreen的荧光增强。
试剂概要
DALGreen不仅可以用荧光显微镜检测,还可以使用流式细胞仪进行检测。DAPGreen可以用荧光酶标仪进行检测,
您可以根据自己的实验条件,使用不同的仪器进行检测。

操作特点
操作流程只有一步-加入试剂
无需基因转染。只需向准备好的细胞加入DALGreen染料,即可方便快捷的进行荧光检测。

实验例
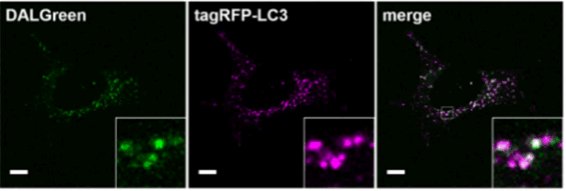
与LC3共染
对已经表达tagRFP-LC3的MEF细胞进行DALGreen共染实验。结果显示,DALGreen的染色部位与自噬体和自噬溶酶体的标记物LC3的位置高度一致。(比例尺:10 μm)
实验的详细情况请参考如下论文:
H. Iwashita,”Small fluorescent molecules for monitoring autophagic flux”, FEBS Letters., 2018, 592, (4), 559–567.
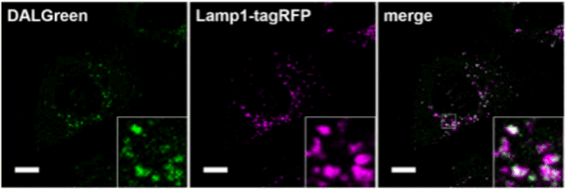
与Lamp-1共染
对已经表达Lamp1-tagRFP的MEF细胞进行DALGreen共染实验。结果显示,DALGreen的染色部位与溶酶体膜蛋白标记物Lamp 1的位置高度一致。(比例尺:10 μm)
实验的详细情况请参考如下论文:
H. Iwashita,”Small fluorescent molecules for monitoring autophagic flux”, FEBS Letters., 2018, 592, (4), 559–567.
ULK1/2敲除细胞的评价
将野生型MEF细胞与已经敲除自噬体膜形成有关的ULK1/2的细胞株一起用雷帕霉素(Rapamycin)和氯喹(Chloroquine)刺激后进行对比实验。结果显示,在野生型细胞中明显观察到荧光增强,而敲除了ULK1/2的细胞中基本观察不到荧光的增强。
实验的详细情况请参考如下论文:
H. Iwashita,”Small fluorescent molecules for monitoring autophagic flux”, FEBS Letters., 2018, 592, (4), 559–567.

细胞延时成像
用DALGreen染色HeLa细胞后,按照下列条件从培养30分钟开始直至培养6小时一直对细胞染色状态进行观察。
・Nutrient Condition: 增殖型培养基
・Autophagic Condition: 不含氨基酸的培养基
<检测条件>
仪器:激光共聚焦高内涵细胞分筛系统(恒河电机株式会社: CQ1)
荧光滤光片:Ex.405 nm / Em.525/50 nm,倍率:20X

DALGreen与其它试剂的长时间染色实验的比较,可进行单一样品随时间变化的长期观察实验。
・由于DALGreen在自噬诱导/抑制剂之前加,所以可以实时观察自噬的进程。另外在不知道自噬诱导/抑制剂的作用时间情况下,与其它试剂相比,用DALGreen更加方便快捷。
每个时间组均需要单独制备样品

・MDC(Monodansylcadaverine)等其它试剂必须要在诱导后加,
需要摸索诱导/抑制剂的作用时间,因此需要准备多组实验,操作复杂,耗费更多的时间和实验材料。
与LC3的对比
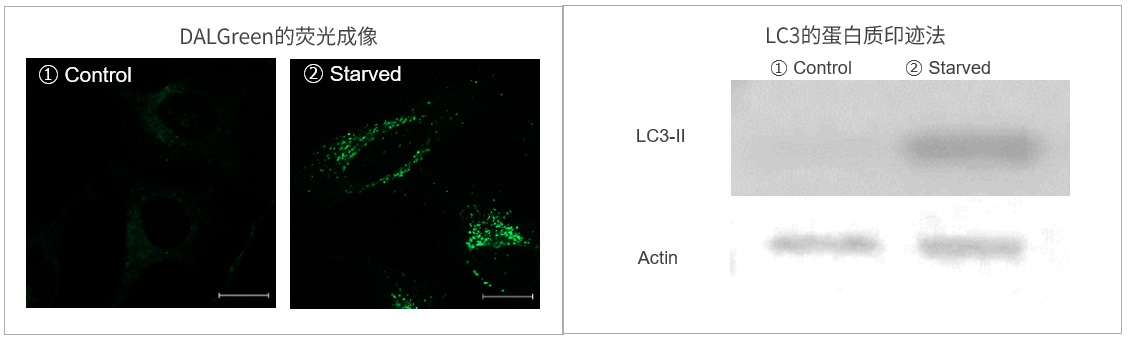
HeLa细胞:①对照组,②饥饿诱导(诱导细胞自噬)组
DALGreen的荧光成像图和细胞自噬因子LC3-Ⅱ表达量结果的对比
结果
DALGreen:饥饿诱导组比Control组荧光增强;LC3-Ⅱ:饥饿诱导组比Control组LC3-Ⅱ表达量增加;
结果表明两者有良好的相关性。
自噬诱导条件
① Control:用培养基培养6小时
② 饥饿诱导:用不含氨基酸培养基培养6小时
DALGreen的显色条件
细胞:HeLa细胞
检测波长:Ex. 488 nm/Em. 500-563 nm
比例尺:20 μm
与MDC的对比
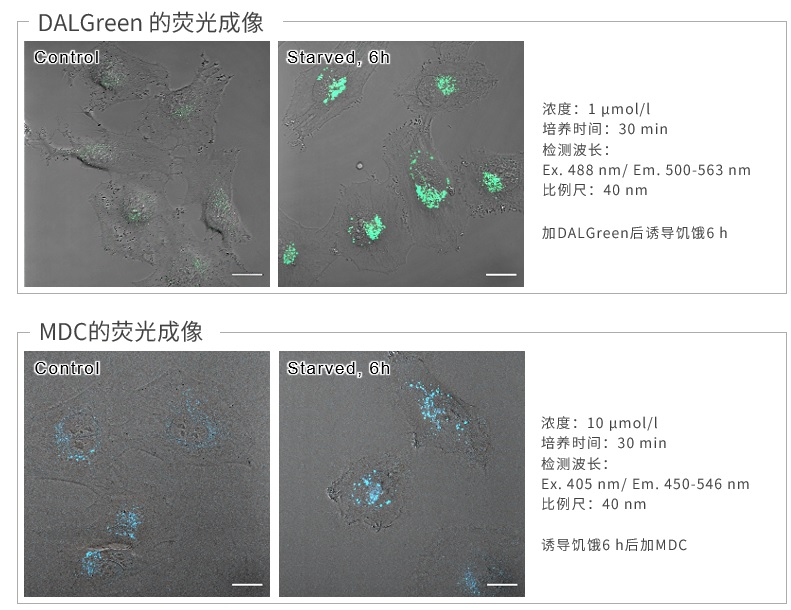
结果
DALGreen和MDC结果:饥饿诱导组均比Control组荧光增强;结果表明两者有良好的相关性。
波长
因为MDC的最大激发波长在紫外区,所以不能用488 nm激发。DALGreen可以采用488 nm激发。
操作
DALGreen:加染料⇒饥饿诱导
MDC :饥饿诱导⇒加染料
由于DALGreen是在饥饿诱导前加入,因此可以动态观察到细胞自噬的过程。
常见问题Q&A
Q1: DALGreen Working Solution的稳定性如何?
A1: 无法长期保存,需要现配现用
Q2: DMSO Stocking Solution 的稳定性如何?
A2:配制后请于-20℃保存,一个月内可保持稳定。另外建议根据用量分装保存。
Q3:如何摸索DALGreen的最佳浓度?
A3 :由于本试剂的特性,如果试剂的浓度太高或太低都会导致诱导自噬的样品组与未诱导自噬的对照组之间的差别不明显。建议参考以下信息摸索试剂的最佳浓度:
DALGreen的最佳浓度根据细胞的种类而不尽相同。
可以考虑从最低浓度(可以0.1 μmol/l作为参考)开始分别多个梯度至最高浓度(可以4 μmol/l作为参考)的步骤进行摸索。
参考例
我们公司对HeLa, HepG2, CHO细胞的最佳浓度进行了摸索。DALGreen以下列浓度进行染色,并在无氨基酸的培养基中培养以诱导自噬。下表中红色字体的浓度可明显观察到实验组与空白组的差异。
A4:溶酶体染因此当溶酶体染色试剂和DALGreen共染时,溶酶体染色试剂发出的荧光与自噬小体的部分DALGreen的荧光发生重叠。
色试剂会定位于细胞内的溶酶体里。而DALGreen是在进入自噬小体后,当自噬小体与溶酶体结合后,荧光变强。Q4: 这个产品和溶酶体染色试剂有什么区别吗?
本实验的数据,请参考下面论文的Supporting Information (Fig.S5)。
H. Iwashita, “Small fluorescent molecules for monitoring autophagic flux”, FEBS Letters., 2018, 592, (4), 559–567.
论文的原文链接在本产品的网站页面上。
网站链接(日语):
http://dominoweb.dojindo.co.jp/goodsr7.nsf/View_Display/D675?OpenDocument
Q5:推荐使用的滤光片?
A5:激发波长:350~450 nm;
发射波长:500~560 nm;
另外利用激光共聚焦显微镜的488 nm激发波长也可以检测,
请参考我们公司网站产品页面的实验例。
Q6:是否有与自噬相关的蛋白质敲除和评估的实例?
A6:与自噬小体成膜有关的ULK1和ULK2敲除的细胞与野生型细胞饥饿诱导,用DALGreen染色后评价的实例是有的。
实验结果显示,与ULK1/ULK2敲除的细胞相比,野生型细胞中的DALGreen荧光信号增大。这次实验的具体数据请参照下面这篇论文的Supporting Information (Fig. S5)
另外,自噬的标记物LC3-RFP与DALGreen的共染色结果显示,大多数的染色Puncta(斑点,位点)都高度一致。本实验的数据,请参考下面论文的Fig.1。
H. Iwashita, “Small fluorescent molecules for monitoring autophagic flux”, FEBS Letters., 2018, 592, (4), 559–567.
论文的原文链接在本产品的网站页面上。
网站链接(日语):
http://dominoweb.dojindo.co.jp/goodsr7.nsf/View_Display/D675?OpenDocument
Q7:自噬有哪些途径?DALGreen可以检测到哪些状态?
A7:众所周知,自噬根据其分子机制可以分为两种:一种是依赖于ATG5的传统自噬(LC3发生变化),另一种则是非依赖于ATG的选择性自噬(LC3形式的转化并未发生)。
DALGreen在形成自噬体膜时掺入其中,当形成自噬溶酶体时,环境变成酸性,DALGreen荧光增强。因此,DALGreen可以检测自噬溶酶体的状态。
*参考资料:发现新的自噬机制Shigeomi Shimizu
https://www.dojindo.co.jp/letterj/160/review/01.html
文献链接:http://dx.doi.org/10.14348/molcells.2018.2215
▶对于首次检测的细胞类型和实验条件,请参考FAQ[如何确定细胞自噬探针DALGreen的最佳浓度]。
Q8:在进行延时成像时有什么要注意的地方吗?
A8:为了确定最佳实验条件,请先进行预实验。
由于试剂的特性,刚刚染色后有荧光值升高的趋势,因此请参照以下步骤进行预实验和延时成像。
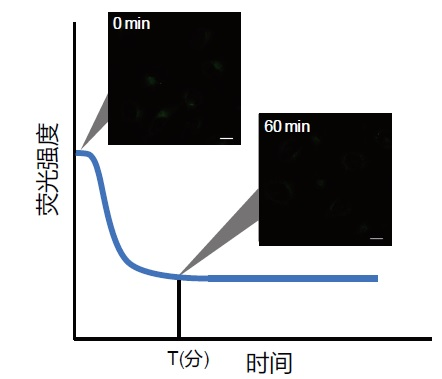
1. 预实验
– 使用对照细胞(不诱导自噬的细胞)。
– 根据说明书的步骤用Working Soluiton染色后,用培养基洗涤2次。
– 加入正常培养基后,观察荧光随时间的变化。
– 如下图所示,染色后的细胞在荧光强度阶段性降低之后,确认荧光强度变化趋于稳定的时间段(图中的T)。
※条件可能因细胞种类而异。
(参考)
HeLa细胞的话,染色后约60分钟后,荧光确定会趋于稳定(DALGreen)。
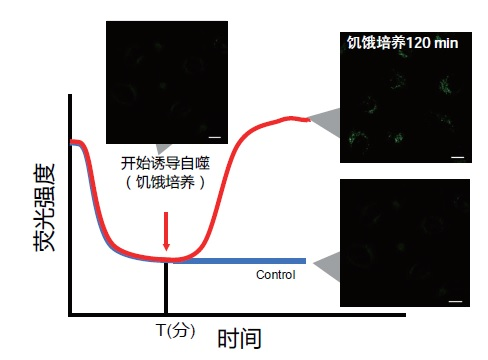
2. 延时染色成像
– 细胞用Working Solution染色后,在培养基中37℃培养。
※培养时间为预实验中摸索出的染色时间。
※染色后不要立刻进行自噬诱导。
-培养后进行自噬诱导并开始延时染色成像。
(参考)
用DALGreen对HeLa细胞进行染色,在正常的培养基中培养60分钟(预实验中摸索的时间)后,进行自噬诱导。
参考文献
|
No. |
检测样品 |
检测仪器 |
引用(含链接) |
|
1) |
细胞 |
荧光显微镜 |
H. Iwashita, H. T. Sakurai, N. Nagahora, M. Ishiyama, K. Shioji, K. Sasamoto, K. Okuma, S. Shimizu, and Y. Ueno, “Small fluorescent molecules for monitoring autophagic flux.”, FEBS Letters., 2018, 592, (4), 559–567. |
|
2) |
细胞 |
荧光显微镜 |
T. Sakata, A. Saito and H. Sugimoto, “In situ measurement of autophagy under nutrient starvation based on interfacial pH sensing.”, Scientific Reports., 2018, 8, 8282. |
|
3) |
细胞 |
荧光显微镜 |
Y. Egawa, C. Saigo, Y. Kito, T. Moriki and T. Takeuchi , “Therapeutic potential of CPI-613 for targeting tumorous mitochondrial energy metabolism and inhibiting autophagy in clear cell sarcoma.”, PLoS One., 2018, 13, (6), e0198940. |
|
4) |
细胞 |
荧光显微镜 |
S. Abe, S. Hirose, M. Nishitani, I. Yoshida, M. Tsukayama, A. Tsuji and K. Yuasa , “Citrus peel polymethoxyflavones, sudachitin and nobiletin, induce distinct cellular responses in human keratinocyte HaCaT cells.“, Biosci. Biotechnol. Biochem. ., 2018, 82, (12), 1347. |
|
5) |
细胞 |
荧光显微镜 |
W. Yuping, M. Congshun, Z. Huihui, Z. Yuxia, C. Zhenguo and W. Liping, “Alleviation of endoplasmic reticulum stress protects against cisplatin-induced ovarian damage.”, Reprod. Biol. Endocrinol., 2018,doi: 10.1186/s12958-018-0404-4. |
|
6) |
细胞 |
荧光显微镜 |
S. Xue, F. Mao, D. Hu, H. Yan, J. Lei, E. Obeng, Y. Zhou, Y. Quan, and W. Yu, “Acetylation of BmAtg8 inhibits starvation-induced autophagy initiation.”, Mol. Cell Biochem., 2019,doi: 10.1007/s11010-019-03513-y. |
|
7) |
细胞 |
荧光显微镜 |
F. Hongbao,Y. Shankun, C. Qixin, L. Chunyan, C. Yuqi, G. Shanshan, B. Yang, T. Zhiqi, L. Z. Amanda, T. Takanori, C.Yuncong, G. Zijian, H. Weijiang and D. Jiajie , “De Novo-Designed Near-Infrared Nanoaggregates for Super-Resolution Monitoring of Lysosomes in Cells, in Whole Organoids, and in Vivo.”, ACS Nano, 2019, 13, (12), 1446. |
|
8) |
细胞 |
流式细胞仪 |
E. Sasabe, A. Tomomura, N. Kitamura and T. Yamamoto, “Metal nanoparticles-induced activation of NLRP3 inflammasome in human oral keratinocytes is a possible mechanism of oral lichenoid lesions.”, Toxicol In Vitro., 2020, 62, 104663. |
|
9) |
细胞 |
荧光显微镜 |
J. Xia, Y. He, B. Meng, S. Chen, J. Zhang, X. Wu, Y. Zhu, Y. Shen, X. Feng, Y. Guan, C. Kuang, J. Guo, Q. Lei, Y. Wu, G. An, G. Li, L. Qiu, F. Zhan and W. Zhou, “NEK2 induces autophagy-mediated bortezomib resistance by stabilizing Beclin-1 in multiple myeloma.”, Mol Oncol, 2020, DOI: 10.1002/1878-0261.12641. |
|
10) |
细胞 |
荧光显微镜 |
Q. Xu, W. Shi, P. Lv, W. Meng, G. Mao, C. Gong, Y. Chen, Y. Wei, X. He, J. Zhao, H. Han, M. Sun and K. Xiao, “Critical role of caveolin-1 in aflatoxin B1-induced hepatotoxicity via the regulation of oxidation and autophagy.”, Cell Death Dis., 2020, 11(1), 6. |
|
11) |
细胞 |
荧光显微镜 |
L Cui, LP Zhao, JY Ye, L Yang, Y Huang, X.P. Jiang, Q. Zhang, JZ. Jia, DX. Zhang and Y. Huang, “The Lysosomal Membrane Protein Lamp2 Alleviates Lysosomal Cell Death by Promoting Autophagic Flux in Ischemic Cardiomyocytes.“, Front Cell Dev Biol, 2020,DOI:10.3389/fcell.2020.00031. |
|
12) |
细胞 |
荧光显微镜 |
Y Yang, J Huang, J Li, H Yang and Y. Yin, “The Effects of Butyric Acid on the Differentiation, Proliferation, Apoptosis, and Autophagy of IPEC-J2 Cells..”, Curr. Mol. Med., 2020, 20(4), 307. |
|
13) |
细胞 (成纤维细胞、肾脏上皮细胞) |
荧光显微镜 |
M. M. Ivanova, J. Dao, N. Kasaci, B. Adewale, J. Fikry and O. G. Alpan , “Rapid Clathrin-Mediated Uptake of Recombinant α-Gal-A to Lysosome Activates Autophagy”, Biomolecules , 2020, 10(6), 837. |
|
14) |
细胞 (NHEKs) |
荧光显微镜 |
S. Ikeoka and A. Kiso , “The Involvement of Mitophagy in the Prevention of UV-B-Induced Damage in Human Epidermal Keratinocytes “, J. Soc. Cosmet. Chem. Jpn., 2020, 54(3), 252. |
|
15) |
细胞 |
荧光显微镜(超分辨率) |
Q. Chen, M. Hao, L. Wang, L. Li, Y. Chen, X. Shao, Z. Tian, R. A. Pfuetzner, Q. Zhong, A. T. Brunger, J. Guan and J. Diao,“Prefused lysosomes cluster on autophagosomes regulated by VAMP8″, 2021, doi:10.1038/s41419-021-04243-0. |


